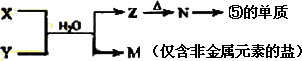题目内容
X和Z在稀硫酸中构成原电池时,Z为正极,所以金属的活动性X>Z;
若电解Y和Z离子共存的溶液时,Y先析出,说明Y离子氧化性强于Z离子,所以金属的活动性Z>Y,M离子的氧化性强于Y离子,所以金属的活动性Y>M,综上可知四种金属的活动性由强到弱的顺序为X>Z>Y>M.
故选D.

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案(15分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA |
| 0 | |||||
| 1 |
| ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
|
| 2 |
|
|
| ① | ⑧ | ② |
|
|
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ |
|
|
|
(1)②、④、⑤的原子半径由大到小的顺序为____________________。
②、④、⑤的离子半径由大到小的顺序为____________________。
(2)①②⑥⑦四种元素所对应的气态氢化物最稳定的是________,最不稳定的是_____(填化学式)。
(3) ②、③可形成既含离子键又含共价键的化合物,其阳离子和阴离子的个数比为_____。
(4)③、⑤两元素最高价氧化物对应水化物发生反应的离子方程式为__________________________。
(5)工业上用①单质大量生产⑥单质,反应的化学方程式为_______________________________。
(6)④⑤两元素相比较,金属性较强的是 (填名称),用原子结构知识解释 ,可以验证该结论的实验是 (填编号)。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同的这两种元素的单质分别和热水作用,并滴入酚酞溶液
(d)分别往氯化镁溶液、氯化铝溶液中逐滴滴入氢氧化钠溶液直到过量。
(7)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为____________ _________,
(15分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ① | ⑧ | ② | | |
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | | | |
②、④、⑤的离子半径由大到小的顺序为____________________。
(2)①②⑥⑦四种元素所对应的气态氢化物最稳定的是________,最不稳定的是_____(填化学式)。
(3)②、③可形成既含离子键又含共价键的化合物,其阳离子和阴离子的个数比为_____。
(4)③、⑤两元素最高价氧化物对应水化物发生反应的离子方程式为__________________________。
(5)工业上用①单质大量生产⑥单质,反应的化学方程式为_______________________________。
(6)④⑤两元素相比较,金属性较强的是 (填名称),用原子结构知识解释 ,可以验证该结论的实验是 (填编号)。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同的这两种元素的单质分别和热水作用,并滴入酚酞溶液
(d)分别往氯化镁溶液、氯化铝溶液中逐滴滴入氢氧化钠溶液直到过量。
(7)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
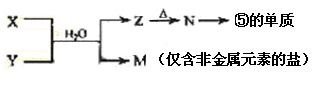
X溶液与Y溶液反应的离子方程式为____________ _________,
(15分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
|
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
① |
⑧ |
② |
|
|
|
3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
|
|
|
(1)②、④、⑤的原子半径由大到小的顺序为____________________。
②、④、⑤的离子半径由大到小的顺序为____________________。
(2)①②⑥⑦四种元素所对应的气态氢化物最稳定的是________,最不稳定的是_____(填化学式)。
(3) ②、③可形成既含离子键又含共价键的化合物,其阳离子和阴离子的个数比为_____。
(4)③、⑤两元素最高价氧化物对应水化物发生反应的离子方程式为__________________________。
(5)工业上用①单质大量生产⑥单质,反应的化学方程式为_______________________________。
(6)④⑤两元素相比较,金属性较强的是 (填名称),用原子结构知识解释 ,可以验证该结论的实验是 (填编号)。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同的这两种元素的单质分别和热水作用,并滴入酚酞溶液
(d)分别往氯化镁溶液、氯化铝溶液中逐滴滴入氢氧化钠溶液直到过量。
(7)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
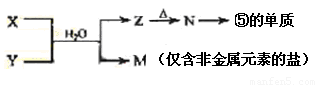
X溶液与Y溶液反应的离子方程式为____________ _________,