题目内容
有关乙炔分子中的化学键描述不正确的是( )
分析:A.乙炔的电子式为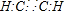 ,乙炔分子中所有原子处于同一直线上;
,乙炔分子中所有原子处于同一直线上;
B.非金属元素之间的单键为σ键,三键中含有一个σ键一个π键;
C.碳原子中未杂化的2p轨道重叠形成π键;
D.根据价层电子对互斥理论确定其杂化方式.
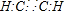 ,乙炔分子中所有原子处于同一直线上;
,乙炔分子中所有原子处于同一直线上;B.非金属元素之间的单键为σ键,三键中含有一个σ键一个π键;
C.碳原子中未杂化的2p轨道重叠形成π键;
D.根据价层电子对互斥理论确定其杂化方式.
解答:解:A.乙炔分子中,碳碳之间形成三键,氢原子和碳原子之间形成σ键,所以乙炔分子中的所有原子处于同一直线上,故A正确;
B.乙炔分子中,碳氢原子之间形成两个σ键,碳碳三键中含有一个σ键和两个π键,所以乙炔分子中含有三个σ键两个π键,故B正确;
C.每个碳原子都有两个未杂化的2p轨道肩并肩重叠形成两个π键,故C正确;
D.每个碳原子含有2个σ键且不含孤电子对,所以采取sp杂化,故D错误;
故选D.
B.乙炔分子中,碳氢原子之间形成两个σ键,碳碳三键中含有一个σ键和两个π键,所以乙炔分子中含有三个σ键两个π键,故B正确;
C.每个碳原子都有两个未杂化的2p轨道肩并肩重叠形成两个π键,故C正确;
D.每个碳原子含有2个σ键且不含孤电子对,所以采取sp杂化,故D错误;
故选D.
点评:本题考查乙炔分子的有关知识,明确乙炔的结构式是解本题的关键,注意σ键是头碰头形成的,π键是肩并肩形成的.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
有关乙炔分子中的化学键描述不正确的是( )
| A、两个碳原子采用sp杂化方式 | B、每个碳原子都有两个未杂化的2p轨道形成π键 | C、两个碳原子采用sp2杂化方式 | D、两个碳原子形成两个π键 |
有关乙炔分子中的化学键描述不正确的是( )
| A、两个碳原子采用sp杂化方式 | B、两个碳原子采用sp2杂化方式 | C、每个碳原子都有两个未杂化的2p轨道形成π键 | D、两个碳原子形成两个π键 |