题目内容
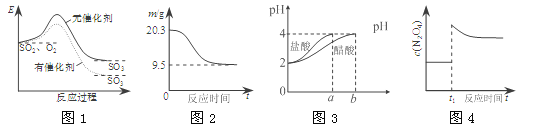
【题目】工业上用CO生产燃料甲醇。一定温度和容积条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。

请回答下列问题:
(1)在“图1”中,曲线_______(填“a”或“b”)表示使用了催化剂;没有使用催化剂时,在该温度和压强条件下反应CO(g)+2H2(g)![]() CH3OH(g)的△H=_________。
CH3OH(g)的△H=_________。
(2)从反应开始到建立平衡,v(CO)=________;达到平衡时,该温度下CO(g)+2H2(g) ![]() CH3OH(g)的化学平衡常数为______________。达到平衡后若保持其它条件不变,将容器体积压 缩为0.5L,则平衡___________移动 (填“正向”、“逆向”或“不”)。
CH3OH(g)的化学平衡常数为______________。达到平衡后若保持其它条件不变,将容器体积压 缩为0.5L,则平衡___________移动 (填“正向”、“逆向”或“不”)。
(3)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g);ΔH=-193kJ/mol。又知H2O(l)= H2O(g);ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式____________。
【答案】 b -91kJ/mol 0.075mol/(L·min) 12 正向 CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-281kJ/mol
【解析】考查化学反应与能量的关系,热化学方程式的书写,盖斯定律的应用,化学平衡理论,反应速率的计算(1)根据催化剂的作用知使用催化剂,降低了反应的活化能,反应速率快;(2)根据化学平衡常数计算公式进行计算;(3)根据盖斯定律完成热化学方程式的书写。
(1)由图像分析b的活化能比a的低,说明使用了催化剂,降低了反应的活化能,反应速率快,所以曲线b表示使用了催化剂;反应热只与始态和终态有关,与反应途经无关。所以反应的反应热不变,△H =419 KJ/mol-510 KJ/mol=-91 KJ/mol;答案:b ;-91kJ/mol。
(2)根据图2分析知道:达平衡时,CO的浓度减小1.00-0.25=0.75mol/L,所以v(CO)= 0.75mol.L-1/10min=0.075mol·L-1·min-1;起始时氢气的浓度为2mol/L,是CO起始浓度的2倍,符合化学方程式中的化学计量数之比,所以平衡时CO的浓度是0.25 mol/L,氢气的浓度为0.5mol/L,甲醇的浓度是0.75 mol/L,化学平衡常数K=0.75 mol.L-1/0.25 mol.L-1×0.52mol/L=12;达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,压强增大了,CO(g)+2H2(g)![]() CH3OH(g)的平衡正向移动。答案:0.075mol/(L·min) 12 正向 。
CH3OH(g)的平衡正向移动。答案:0.075mol/(L·min) 12 正向 。
(3)①CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)ΔH=-193kJ/mol,②H2O(l)= H2O(g) ΔH=+44 kJ/mol,根据盖斯定律,所求热化学方程式=①-②×2,32g的CH3OH(g)的物质的量是1mol,所以热化学方程式为CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-281kJ/mol。

 高效智能课时作业系列答案
高效智能课时作业系列答案