题目内容
【题目】下列说法正确的是
A.链节是高分子化合物中重复出现的结构单元,如聚乙烯的链节是CH2=CH2
B.丙烯和聚丙烯都能使溴水褪色
C.高分子化合物没有固定的熔沸点
D.加聚反应生存环境高分子化合物的同时,还有H2O等小分子物质生成
【答案】C
【解析】
A.高分子化合物中重复出现的结构单元是链节,聚乙烯的链节是-CH2-CH2-,A错误;
B.聚丙烯中不含有不饱和的碳碳键,不能使溴水褪色,B错误;
C.高分子化合物为混合物,没有固定的熔沸点,C正确;
D.加聚反应生存环境高分子化合物的同时不会生成小分子物质,D错误;
答案选C。

【题目】根据下列实验事实,不能得到相应结论的是
选项 | 实验操作和现象 | 结论 |
A | 向醋酸溶液中滴加少量Na2SiO3溶液,观察到白色沉淀 | 醋酸的酸性强于H2SiO3 |
B | 向均盛有2mL5% H2O2溶液的两支试管中分别滴入0.2mol/LFeCl3和0.3mol/LCuCl2溶液各1mL,前者生成气泡的速率更快 | 催化效果: Fe3+> Cu2+ |
C | 向一定浓度的醋酸溶液中加入镁条,产生气泡的速率会先加快再减慢 | 反应产生气泡速度变化,是因为醋酸电离平衡先正向移动,再逆向移动 |
D | 常温下分别测等浓度的醋酸和氨水pH,二者的pH 分别为2和12 | 常温下,醋酸和氨水的电离平衡常数相等 |
A. A B. B C. C D. D
【题目】盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的化学试剂。
Ⅰ.测定中和热.
(1)写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式__________(中和热数值为57.3kJ/mol)。
(2)取50mL 0.5mol/L HCl溶液与50mL0.55mol/L NaOH溶液进行测定,但实验数值小于57.3kJ/mol,原因不可能是_______(填序号).
A.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
B.量取盐酸的体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
D.实验装置保温、隔热效果差
Ⅱ.酸碱中和滴定.
欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是__________________________。
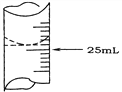
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10 mL,滴定后液面如图,则此时消耗标准溶液的体积为___________。
乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 33.30 |
3 | 25.00 | 0.22 | 26.31 |
(3)选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为________________(小数点后保留四位)。
(4)下列哪些操作会使测定结果偏高___________(填序号)。
A.锥形瓶用蒸馏水洗净后,直接注入待测溶液进行滴定
B.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
C.碱式滴定管用蒸馏水洗涤后立即取用25.00mL待测液注入锥形瓶中进行滴定
D.滴定前俯视滴定管读数,滴定后平视滴定管读数
(5)滴定达到终点的标志是_________________________________________________。
【答案】 H+(aq)+OH-(aq)= H2O(l)△H=-57.3kJ·mol-1 B 用碱液润洗 23.80mL 0.1044 mol·L-1 BD 滴入最后一滴标准液,溶液由红色变为无色,且半分钟内不复原
【解析】 I.(1).强酸强碱的中和热为-57.3kJ/mol,即强酸和强碱的稀溶液完全反应生成1mol水放出的热量为57.3kJ,则稀盐酸和稀氢氧化钠溶液反应的中和热的热化学方程式:H+(aq)+OH-(aq)= H2O(l) △H=-57.3kJ·mol-1;故答案为:H+(aq)+OH-(aq)= H2O(l) △H=-57.3kJ·mol-1;
(2).A.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度,则残留在温度计上的NaOH会与盐酸反应,使盐酸的起始温度偏高,温度差偏小,中和热的数值偏小,故A正确;B.量取盐酸的体积时仰视读数,会导致所量取的盐酸体积偏大,放出的热量偏高,中和热的数值偏大,故B错误;C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失较多,中和热的数值偏小,故C正确;D.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故D正确;因此答案选B
II. (1)碱式滴定管用蒸馏水洗净后,接下来应该用待测的NaOH溶液进行润洗,否则会将NaOH溶液稀释,造成实验误差,故答案为:用碱液润洗;
(2).由图可知,滴定后液面的读数为:24.90mL,因滴定前滴定管内液面读数为1.10 mL,则此时消耗标准溶液的体积为:(24.90-1.10)mL=23.80mL,故答案为:23.80mL;
(3).由表中数据可知,第1次消耗标准液的体积是:(26.11-0.00)mL=26.11mL,第2次消耗标准液的体积是:(33.30-1.56)mL=31.74mL,第3次消耗标准液的体积是:(26.31-0.22)mL=26.09mL,因第2次数据误差较大,故舍去,则消耗标准液的平均体积是:(26.11+26.09)mL÷2=26.10mL,所以NaOH溶液的物质的量浓度为:c(NaOH)=![]() = 0.1044 mol·L-1,故答案为:0.1044 mol·L-1;
= 0.1044 mol·L-1,故答案为:0.1044 mol·L-1;
(4). A.锥形瓶用蒸馏水洗净后,直接注入待测溶液进行滴定,对实验结果无影响,故A错误;B.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液,则消耗标准液体积偏大,测定结果偏高,故B正确;C.碱式滴定管用蒸馏水洗涤后立即取用25.00mL待测液注入锥形瓶中进行滴定,则所取待测液偏少,消耗标准液的体积偏少,测定结果偏低,故C错误;D.滴定前俯视滴定管读数,滴定后平视滴定管读数,则导致所量取的标准液体积偏大,测定结果偏高,故D正确;答案选BD;
(5). 到滴定终点时,当滴入最后一滴标准液,溶液会由红色变为无色,且半分钟内不复原,故答案为:滴入最后一滴标准液,溶液由红色变为无色,且半分钟内不复原。
【题型】实验题
【结束】
26
【题目】铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:
2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:
温度/℃ | 1 000 | 1 150 | 1 300 |
平衡常数 | 64.0 | 50.7 | 42.9 |
请回答下列问题:
①该反应的平衡常数表达式K=__________,ΔH_______0(填“>”、“<”或“=”)。
②欲提高反应中CO的平衡转化率,可采取的措施是_____________________。
A.减少Fe的量 B.加入合适的催化剂
C.增大容器的体积 D.降低反应的温度
③在一个容积为1 L的密闭容器中,1000 ℃时加入Fe2O3、CO各2 mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率v(CO)=______________,Fe2O3的平衡转化率为________。
(2)饱和Mg(OH)2溶液中滴加FeCl3溶液,产生红褐色沉淀, 反应的离子方程式是________________________________________。
(3)已知:2Fe(s)+3/2O2(g)=Fe2O3(s) △H=824 kJ·mol-1、2Al(s)+3/2O2(g)=Al2O3(s) △H=1675.7 kJ·mol-1。则铝与Fe2O3发生反应生成Al2O3和Fe的热化学方程式为 :___________________________。