题目内容
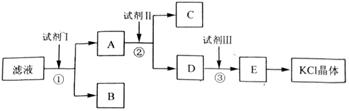
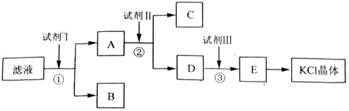
[2012·全国卷](12分)氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。
回答下列问题:
(1)起始滤液的pH_ _7(填“大于”、“小于”或“等于”),其原因是____________;
(2)试剂Ⅰ的化学式为______,①中发生反应的离子方程式为___________ ______;
(3)试剂Ⅱ的化学式为______,②中加入试剂Ⅱ的目的是____________ ________;
(4)试剂Ⅲ的名称是________,③中发生反应的离子方程式为_________ ____;
(5)某同学称取提纯的产品0.775 9 g,溶解后定容在100 mL容量瓶中,每次取25.00 mL溶液,用0.100 0 mol·L-1的硝酸银标准溶液滴定,三次滴定消耗标准溶液的平均体积为25.62 mL,该产品的纯度为_________________________________(列式并计算结果)。
(12分)(1)大于 弱酸强碱盐K2CO3发生水解使体系呈碱性
(2)BaCl2 Ba2++CO32-===BaCO3↓、Ba2++SO42-===BaSO4↓
(3)K2CO3 除去A中的Ba2+离子
(4)盐酸 CO32-+2H+===H2O+CO2↑
(5)×100%=98.40%
【解析】本题为实验流程分析题,主要考查了元素化合物的有关知识以及实验数据的处理。在除杂时,为了彻底将杂质除去,一般加入的除杂试剂都是过量的,这就要求后来加入的除杂试剂能与开始加入的除杂试剂反应而将其除去,而后来加入的除杂试剂在后续操作中也应易除去。故应先加入氯化钡溶液除去硫酸钾,过滤后再向滤液中加入碳酸钾以除去Ba2+,再过滤后向滤液中加足量盐酸,以除去CO32-,最后加热浓缩蒸干得到纯净的氯化钾固体(过量的盐酸在加热蒸干过程挥发)。故试剂Ⅰ为氯化钡溶液,试剂Ⅱ为碳酸钾溶液,试剂Ⅲ为盐酸。

 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案[2012·全国卷] 能正确表示下列反应的离子方程式的是( )
| A.硫酸铝溶液中加入过量氨水:Al3++3OH-===Al(OH)3↓ |
| B.碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO32-===CaCO3↓+2OH- |
| C.冷的氢氧化钠溶液中通入氯气:Cl2+2OH-===ClO-+Cl-+H2O |
| D.稀硫酸中加入铁粉:2Fe+6H+===2Fe3++3H2↑ |