题目内容
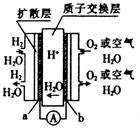
(12分)氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为KOH,其正极反应为____________________________,
负极反应为__________________________________________;
(2)若电解质溶液为硫酸,其正极反应为______________________,负极反应为_________________;若在常温下转移2mol电子,可产生水质量为_________g。
(3)还有一个很大的优点是 。
(1)若电解质溶液为KOH,其正极反应为____________________________,
负极反应为__________________________________________;
(2)若电解质溶液为硫酸,其正极反应为______________________,负极反应为_________________;若在常温下转移2mol电子,可产生水质量为_________g。
(3)还有一个很大的优点是 。
(12分)(1) 正极:O2+4e- + 2 H2O=4OH- 负极:2 H2 -4 e- + 4 OH-=4 H2O
(2) 正极:O2+4e-+ 4 H+ = 2 H2O 负极:2H2 -4 e-= 4 H+ 18 g (3)产物无污染
(2) 正极:O2+4e-+ 4 H+ = 2 H2O 负极:2H2 -4 e-= 4 H+ 18 g (3)产物无污染
(1)原电池中负极失去电子,发生氧化反应,正极得到电子,发生还原反应。因此氢气在负极通入,氧气在正极通入。如果电解质是氢氧化钾,则正极电极反应式是O2+4e- + 2 H2O=4OH- ;负极电极反应式是2 H2 -4 e- + 4 OH-=4 H2O。
(2)如果电解质是稀硫酸溶液,则正极电极反应式是O2+4e-+ 4 H+ = 2 H2O ;负极电极反应式是2H2 -4 e-= 4 H+。若在常温下转移2mol电子,则根据电极反应式可知,生成1mol水,质量是18g。
(3)由于氢气和氧气生成的是水,所以其优点是产物无污染。
(2)如果电解质是稀硫酸溶液,则正极电极反应式是O2+4e-+ 4 H+ = 2 H2O ;负极电极反应式是2H2 -4 e-= 4 H+。若在常温下转移2mol电子,则根据电极反应式可知,生成1mol水,质量是18g。
(3)由于氢气和氧气生成的是水,所以其优点是产物无污染。

练习册系列答案
相关题目