题目内容
【题目】温度为t℃时,在l0mLl.0mol·L-1的盐酸中,逐滴滴入xmol·L-1的氨水,随着氨水逐渐加入,溶液中的温度变化曲线(曲线I)和pH变化曲线(曲线II)如下图所示(忽略混合时溶液体积的变化)。下列有关判断正确的是
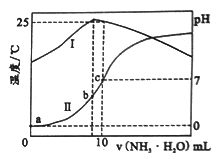
A. x=1.0
B. a点时,水的电离程度最大
C. b点时,c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D. c 点时,c(NH3·H2O)=![]() mol·L-1
mol·L-1
【答案】D
【解析】A.NH4Cl的水溶液显酸性,而c点溶液显中性,说明氨水与HCl溶液等体积混合时,所得溶液为氯化铵和氨水,可知氨水过量,则c(NH3H2O)>1.0molL-1,故A错误;B.根据图象可知,a点时溶液酸性最强,为盐酸,水的电离程度受到抑制,水的电离程度最小,故B错误;C.b点时溶液的pH<7,则c(H+)>c(OH-),根据电荷守恒可知:c(Cl-)>c(NH4+),溶液中正确的离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故C错误;D.根据图象可知,25℃时溶液的pH=7,则:c(H+)=c(OH-)=10-7molL-1,c(NH4+)=c(Cl-)=0.5mol/L,根据物料守恒可知:c(NH3H2O)=(0.5x-0.5)mol/L=![]() mol/L,故D正确;故答案为D。
mol/L,故D正确;故答案为D。

 口算能手系列答案
口算能手系列答案【题目】工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)ΔH在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g)ΔH在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法正确的是()
A. 0~10 min内,T1时V(CH4)的平均反应速率比T2时的平均反应速率小
B. T2时,CH4的平衡转化率为35%
C. T1时,40min后,断裂4molC-H键同时生成4molO-H
D. 该反应的ΔH >0,T1<T2
【题目】下列有机化学反应方程式及反应类型均正确的是( )
选项 | 化学反应方程式 | 反应类型 |
A | CH3COOH+CH3CH2OH | 取代反应 |
B | CH4+Cl2 | 置换反应 |
C | CH3CH=CH2+Br2 CH2BrCH2CH2Br | 加成反应 |
D |
| 取代反应 |
A. A B. B C. C D. D
【题目】从下列实验事实所引出的相应结论正确的是 ( )
选项 | 实验事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越短 | 当其他条件不变时,增大反应物浓度化学反应速率加快 |
B | 在化学反应前后,催化剂的质量和化学性质都没有发生改变 | 催化剂一定不参与化学反应 |
C | 物质的量浓度相同的盐酸和醋酸分别与等质量的形状相同的锌粒反应 | 反应开始速率相同 |
D | 在容积可变的密闭容器中发生反应H2(g)+I2(g) | 正反应速率加快,逆反应速率不变 |
A. A B. B C. C D. D