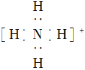题目内容
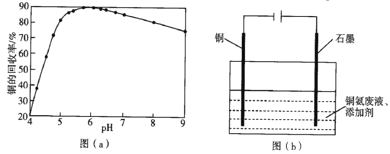
【题目】已知HA的酸性弱于HB的酸性。25℃时,用NaOH固体分别改变物质的量浓度均为0.1molL-1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A-、B-的物质的量浓度的负对数与溶液的pH的变化情况如图所示。下列说法正确的是( )

A.曲线Ⅰ表示溶液的pH与-lgc(A-)的变化关系
B.![]() =1000
=1000
C.溶液中水的电离程度:M>N
D.N点对应的溶液中c(Na+)<Q点对应的溶液中c(Na+)
【答案】D
【解析】
A. HA的酸性弱于HB的酸性,则Ka(HA) < Ka(HB),加入NaOH变为中性时,HA加入的NaOH固体量少,c(Na+)离子浓度小,c(A)离子浓度小,则lgc(A)大,因此曲线II表示pH与1gc(A)的关系,故A错误;
B. 对于HA,取点(10,2),则c(H+)=1010 mol![]() L1,c(A)=102 mol
L1,c(A)=102 mol![]() L1,则
L1,则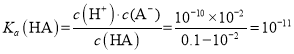 ,同理对于HB,取点(8,2),则c(H+)=108 mol
,同理对于HB,取点(8,2),则c(H+)=108 mol![]() L1,c(B)=102 mol
L1,c(B)=102 mol![]() L1,则
L1,则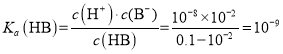 ,所以Ka(HB):Ka(HA)= 109: 1011 =100,故B错误;
,所以Ka(HB):Ka(HA)= 109: 1011 =100,故B错误;
C. M点和N点溶液中c(A)=c(B),M点是酸电离占主要显酸性,是抑制水的电离溶液,N点是盐水解占主要显碱性,所以水的电离程度M < N,故C错误;
D. 对于N点溶液,存在电荷守恒:c(Na+)+c(H+)=c(OH)+c(B),对于Q点溶液,存在电荷守恒:c(Na+)+c(H+)=c(OH)+c(A),N点和Q点溶液pH相同,则两溶液中c(H+)和c(OH)分别相等,但c(B)<c(A),则N点对应的溶液中c(Na+)<Q点对应的溶液中c(Na+),故D正确。
综上所述,答案为D。

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目