题目内容
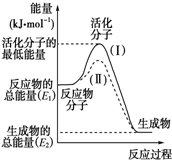 (1)图中所示反应是
(1)图中所示反应是放热
放热
(填“吸热”或“放热”)反应,该反应的△H=E2-E1
E2-E1
(用含E1、E2的代数式表示).(2)已知热化学方程式:H2(g)+
| 1 |
| 2 |
409.0kJ/mol
409.0kJ/mol
.(3)1L 1mol/L H2SO4溶液与2L 1mol/L NaOH溶液完全反应,放出114.6kJ的热量,由此推知H2SO4与NaOH反应的中和热的热化学方程式为
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
(4)向1L 1mol/L的NaOH溶液中加入:①浓H2SO4;②稀硝酸; ③稀醋酸,
恰好完全反应的热效应△H1、△H2、△H3的大小关系为
△H3>△H2>△H1
△H3>△H2>△H1
.分析:(1)依据图象分析反应物的能量大于生成物的能量,反应放热;反应的焓变=生成物的能量-反应物的能量;
(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,逆反应的活化能=正反应的活化能+反应的焓变;
(3)根据中和热的定义计算反应热;
(3)浓硫酸溶于水放热,醋酸为弱电解质,溶于水吸热.
(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,逆反应的活化能=正反应的活化能+反应的焓变;
(3)根据中和热的定义计算反应热;
(3)浓硫酸溶于水放热,醋酸为弱电解质,溶于水吸热.
解答:解:(1)依据图象分析反应物的能量大于生成物的能量,反应放热;反应的焓变=生成物的能量-反应物的能量,则△H=E2-E1,
故答案为:放热;E2-E1;
(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,逆反应的活化能=正反应的活化能+反应的焓变;H2(g)+
O2(g)═H2O(g)△H=-241.8kJ?mol-1,该反应的活化能为167.2kJ?mol-1,则其逆反应的活化能=167.2kJ/mol+241.8kJ/mol=409.0kJ/mol,
故答案为:409.0kJ/mol;
(3)1L 1mol/L H2SO4溶液与2L 1mol/L NaOH溶液完全反应,放出114.6kJ的热量,则生成1mol水放出57.3kJ的热量,反应的热化学方程式为
H2SO4(aq)+NaOH(aq)═
Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol,
故答案为:
H2SO4(aq)+NaOH(aq)═
Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
(3)浓硫酸溶于水放热,醋酸为弱电解质,溶于水吸热,因反应热为负值,放出的热量越多,则△H越小,则△H3>△H2>△H1,
故答案为:△H3>△H2>△H1.
故答案为:放热;E2-E1;
(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,逆反应的活化能=正反应的活化能+反应的焓变;H2(g)+
| 1 |
| 2 |
故答案为:409.0kJ/mol;
(3)1L 1mol/L H2SO4溶液与2L 1mol/L NaOH溶液完全反应,放出114.6kJ的热量,则生成1mol水放出57.3kJ的热量,反应的热化学方程式为
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:
| 1 |
| 2 |
| 1 |
| 2 |
(3)浓硫酸溶于水放热,醋酸为弱电解质,溶于水吸热,因反应热为负值,放出的热量越多,则△H越小,则△H3>△H2>△H1,
故答案为:△H3>△H2>△H1.
点评:本题考查了化学反应的能量变化与反应的焓变关系的分析判断,中和热概念的理解,反应活化能的判断计算,图象的综合应用,读懂图象,焓变和活化能计算方法的理解是关键.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
 Ⅰ:反应C(s)+H2O(g)?CO(g)+H2(g)在一容积可变的密闭容器中进行,试回答:
Ⅰ:反应C(s)+H2O(g)?CO(g)+H2(g)在一容积可变的密闭容器中进行,试回答: 在化学反应中,只有活化分子才能发生有效碰撞而发生化学反应.使普通分子变成活化分子所需提供的平均能量叫活化能,其单位通常用kJ?mol-1表示.请观察如图,回答下列问题:
在化学反应中,只有活化分子才能发生有效碰撞而发生化学反应.使普通分子变成活化分子所需提供的平均能量叫活化能,其单位通常用kJ?mol-1表示.请观察如图,回答下列问题: 只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些
只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些
 代数式表示)。
代数式表示)。