题目内容
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | H2O2、SO2都能使酸性高锰酸钾褪色 | 前者表现出还原性后者表现出漂白性 |
| B | 纯银器表面在空气中渐渐变暗 | 发生了化学腐蚀 |
| C | SiO2能与氢氟酸及碱反应 | SiO2是两性氧化物 |
| D | BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀 | 说明Ksp(BaSO4)大于Ksp(BaCO3) |
B
解析试题分析:A、H2O2、SO2都能使酸性高锰酸钾褪色,都是表现还原性,A不正确;B、银在空气中容易被氧气氧化而变暗,属于化学腐蚀,B正确;C、能与碱和酸反应都生成盐和水的氧化物是两性氧化物,二氧化硅只能与氢氟酸反应生成四氟化硅和水,因此二氧化硅是酸性氧化物,C不正确;D、只要溶液中c(CO32-)·c(Ba2+)>Ksp(BaCO3)即可产生碳酸钡沉淀,与硫酸钡的溶度积常数并无直接关系,D不正确,答案选B。
考点:考查物质性质以及溶度积常数的应用

现有等物质的量的铜和银的混合物17.2 g,与50.0 mL的浓硝酸恰好完全反应,产生气体4.48 L(标准状况),则下列说法正确的是
| A.产生的气体是0.2 mol NO2 |
| B.硝酸的物质的量浓度为12 mol·L-1 |
| C.反应中被还原和未被还原的硝酸物质的量之比为3∶2 |
| D.要使产生的气体恰好完全被水吸收需要通入氧气0.075 mol |
NO因污染空气而“臭名昭著”,而奇妙的作用也使其成为“明星分子”。如可用于制HNO3、肥料、炸药、促进血管扩张、促进免疫功能、增强记忆等。下列各组物质中,不能生成NO的是( )
| A.Cu + HNO3(稀) | B.N2 + O2 | C.NH4Cl + O2 | D.NO2 + H2O |
下列关于液氯的说法中,不正确的是
| A.液氯属于混合物 | B.液氯呈黄绿色 |
| C.液氯是一种有色、有味、有毒的液体 | D.液氯能使湿润的红色布条褪色 |
两种大气污染物NO2和SO2在一定条件下可发生如下反应:NO2 + SO2 NO + SO3,在体积为VL的密闭容器中通入amolNO2和bmolSO2,反应后容器内硫原子和氧原子的个数比为( )
NO + SO3,在体积为VL的密闭容器中通入amolNO2和bmolSO2,反应后容器内硫原子和氧原子的个数比为( )
A. | B.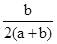 | C. | D.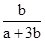 |
下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是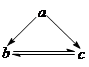
| 选项 | a | b | c |
| A | Cl2 | HClO | Ca(ClO)2 |
| B | CH3CHO | CH3CH2OH | CH3COOC2H5 |
| C | HNO3 | NO | NO2 |
| D | CH2=CH2 | CH3CH2Br | CH3CH2OH |
下列物质的使用不涉及化学变化的是
| A.明矾用作净水剂 | B.液氨用作制冷剂 |
| C.氢氟酸刻蚀玻璃 | D.生石灰作干燥剂 |
将18 g铜和铁的混合物投入200 mL稀硝酸中,充分反应后得到标准状况下2.24 L NO,剩余9.6 g金属;继续加入200 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下2.24 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法中正确的是( )
| A.原混合物中铜和铁各0.15 mol | B.稀硝酸的物质的量浓度为1 mol·L-1 |
| C.第一次剩余9.6 g金属为铜和铁 | D.再加入上述200 mL稀硝酸,还会得到标准状况下2.24 L NO |
“封管实验”具有简易、方便、节约、绿色等优点,观察下列四个“封管实验”(夹持装置未画出),判断下列说法正确的是 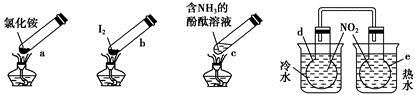
| A.加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好 |
| B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体 |
| C.加热时,c中溶液红色变深,冷却后又变浅 |
| D.e内气体颜色变浅,d内气体颜色加深 |