题目内容
19.下列说法中正确的是( )| A. | 天然气和沼气的主要成分是甲烷 | |
| B. | 石油裂解可以得到氯乙烯 | |
| C. | 所有烷烃中都存在碳碳单键 | |
| D. | 溴乙烷与NaOH乙醇溶液共热生成乙烯 |
分析 A.天然气、坑道气、沼气等均含甲烷;
B.石油裂解得到烃类物质;
C.甲烷只有1个C;
D.溴乙烷与NaOH乙醇溶液共热,发生消去反应.
解答 解:A.天然气和沼气的主要成分是甲烷,甲烷能燃烧,则利用天然气、沼气作能源使用,故A正确;
B.石油裂解得到烃类物质,含烯烃类物质,但氯乙烯为卤代烃,故B错误;
C.甲烷只有1个C,不存在碳碳单键,故C错误;
D.溴乙烷与NaOH乙醇溶液共热,发生消去反应,生成乙烯和NaBr,故D正确;
故选AD.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机物的组成、反应类型等为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
9.X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图转化关系(其它产物已略去):下列说法不正确的是( )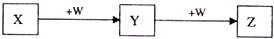

| A. | 若W是单质铁,则Z溶液可能是FeCl2溶液 | |
| B. | 若W是氢氧化钠,则X与Z可反应生成Y | |
| C. | 若W是强氧化性的单质,则X可能是金属铝 | |
| D. | 若W是氧气,则X、Z的相对分子质量可能相差14 |
10.实验室制取少量N2常利用的反应是:NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O,关于该反应的说法正确的是( )
| A. | NaNO2是氧化剂 | B. | 生成1molN2时转移的电子为3mol | ||
| C. | NH4Cl中的N元素被还原 | D. | N2既是氧化剂又是还原剂 |
7.室温下,对于0.1mol?L-1的氨水,下列有关说法正确的是( )
| A. | 氨水能导电,说明NH3是电解质 | |
| B. | 加水稀释,溶液中的c(OH-)增大 | |
| C. | 加入稀硫酸至溶液的pH=7,c(NH4+)=c(SO42-) | |
| D. | 向含有酚酞的氨水中加入少量NH4Cl晶体,溶液颜色变浅 |
14.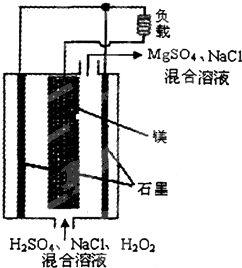 镁-过氧化氢燃料电池具有比能量高、安全方便等优点,其结构示意如图所示.关于该电池的叙述正确的是( )
镁-过氧化氢燃料电池具有比能量高、安全方便等优点,其结构示意如图所示.关于该电池的叙述正确的是( )
 镁-过氧化氢燃料电池具有比能量高、安全方便等优点,其结构示意如图所示.关于该电池的叙述正确的是( )
镁-过氧化氢燃料电池具有比能量高、安全方便等优点,其结构示意如图所示.关于该电池的叙述正确的是( )| A. | 电池工作时,H+向正极移动 | |
| B. | 该电池可以在高温下正常工作 | |
| C. | 电池工作时,正极周围溶液的pH将不断变小 | |
| D. | 该电池的总反应式为:Mg+H2O2+H2SO4═MgSO4+2H2O |
4.下列说法正确的是( )
| A. | 在氧化还原反应中,氧化剂与还原剂不可能是同一种物质 | |
| B. | 氧化剂在反应中被氧化,还原剂在反应中被还原 | |
| C. | 阳离子只有氧化性,阴离子只有还原性 | |
| D. | 物质中若含有处于中间价态的元素,则该物质可能既具有氧化性又具有还原性 |
11.下列溶液中,跟100mL 0.5mol/L NaCl溶液所含的Cl-物质的量浓度相同的是( )
| A. | 100 mL 0.5 mol/L MgCl2溶液 | B. | 200 mL 0.25 mol/L AlCl3溶液 | ||
| C. | 50 mL 1mol/L NaCl溶液 | D. | 25 mL 0.5 mol/L HCl溶液 |
8.某高聚物可表示为图所示,则下列叙述不正确的是( )
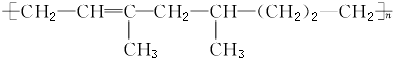
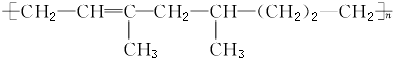
| A. | 该高聚物是通过加聚反应生成的 | |
| B. | 合成该高聚物的单体有三种 | |
| C. | 1 mol该物质能与1 mol H2加成,生成不含碳碳双键的物质 | |
| D. | 该高聚物能被酸性KMnO4溶液氧化 |
9.下列叙述表示可逆反应N2+3H2?2NH3一定处于平衡状态的是( )
| A. | N2、H2、NH3的百分含量相等 | |
| B. | 单位时间,消耗a mol N2的同时消耗3mol H2 | |
| C. | 单位时间,消耗a molN2的同时生成3a mol H2 | |
| D. | 反应若在定容的密器中进行,温度一定时,压强不随时间改变 |