题目内容
【题目】将一定量的NaHCO3和Na2CO3的混合物放在密闭的容器中加热,充分反应后,测得容器中CO2的体积为4.48L(标准状况)。将反应后的固体与200ml某浓度的盐酸恰好完全反应,转化为8.96LCO2。试回答:(注2NaHCO3![]() Na2CO3 +CO2
Na2CO3 +CO2![]() +H2O)
+H2O)
(1)盐酸的物质的量浓度为多少?__________
(2)原混合物中NaHCO3质量为________;Na2CO3的质量为_________
【答案】
(1)4mol/L;(2)33.6g、21.2g
【解析】
试题分析:(1)设碳酸钠与盐酸恰好完全反应时HCl的物质的量为x,碳酸钠的质量为y,则生成的二氧化碳的物质的量为![]() =0.4mol。
=0.4mol。
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106g 2mol 1mol
y x 0.4mol
![]() =
=![]() ,解得x=0.8mol,
,解得x=0.8mol,![]() =
=![]() ,解得y=42.4g,盐酸的物质的量浓度为
,解得y=42.4g,盐酸的物质的量浓度为![]() =4mol/L,答:盐酸的物质的量浓度为4mol/L;
=4mol/L,答:盐酸的物质的量浓度为4mol/L;
(2)加热固体生成的二氧化碳的物质的量为![]() =0.2mol,
=0.2mol,
设碳酸氢钠的质量为z,生成的碳酸钠的质量为m,则
2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
168g 106g 1mol
z m 0.2mol
![]() =
=![]() =
=![]() ,解得z=33.6g,m=21.2g,
,解得z=33.6g,m=21.2g,
则原混合物中的Na2CO3的质量为42.4g-21.2g═21.2g,
答:原混合物中NaHCO3的质量为33.6g,Na2CO3的质量为21.2g。

【题目】如图是CO2生产甲醇的能量变化示意图.下列说法正确的是( )
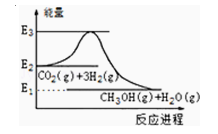
A.E2_E1是该反应的热效应
B.E3_E1是该反应的热效应
C.该反应放热,在常温常压下就能进行
D.实现变废为宝,且有效控制温室效应
【题目】如图中U→Z六种物质在适当条件下能实现图示箭头方向一步转化,且反应①、②均为置换反应,满足条件的物质组是( )
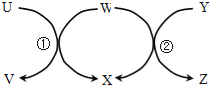
序号 | U | W | Y | X |
① | Na | H2O | Na2O2 | NaOH |
② | Fe | H2O | C | H2 |
③ | HBr | Cl2 | CH4 | HCl |
④ | CuCl2(aq) | Al | HCl(aq) | AlCl3(aq) |
A.②④ B.②③ C.①②④ D.①②③④