题目内容
【题目】根据要求完成下列问题:
(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,试回答:
该元素价电子排布式_____________________。
(2)外围电子排布式为3d54s2的原子,其原子结构示意图为____________,其最高正价为________;其在元素周期表中的位置为:___________________。
(3)下列分子中是否有手性原子:_________(填“有”或“无”,若有请在图中碳原子下方用“*”标出)

(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧、PCl3中,属于非极性分子的是(填番号)________________。
(5) 试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):
HClO3________HClO4; H3PO4________H3PO3。
【答案】 3d14s2  +7 第4周期VIIB族 有;
+7 第4周期VIIB族 有;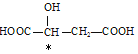 ①③④⑦ < >
①③④⑦ < >
【解析】(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,则该元素的核外电子数是18+1+2=21,所以该元素价电子排布式为3d14s2;(2)外围电子排布式为3d54s2的原子是Mn,其原子结构示意图为 ,其最高正价为+7价;其在元素周期表中的位置为第4周期VIIB族;(3)与羟基相连的碳原子连接的4个基团均不相同,属于手性碳原子;(4)①CO2直线形结构,属于非极性分子;②NH3是三角锥形,是极性分子;③CCl4是正四面体型,是非极性分子;④BF3是平面三角形,是非极性分子;⑤H2O是V形,是极性分子;⑥SO2是V形,是极性分子;⑦SO3是平面三角形,是非极性分子;⑧PCl3是三角锥形,是极性分子,因此属于非极性分子的是①③④⑦;(5) 氯酸分子中非羟基氧原子个数小于高氯酸中非羟基氧原子个数,因此氯酸的酸性小于高氯酸;同样磷酸的酸性强于亚磷酸。
,其最高正价为+7价;其在元素周期表中的位置为第4周期VIIB族;(3)与羟基相连的碳原子连接的4个基团均不相同,属于手性碳原子;(4)①CO2直线形结构,属于非极性分子;②NH3是三角锥形,是极性分子;③CCl4是正四面体型,是非极性分子;④BF3是平面三角形,是非极性分子;⑤H2O是V形,是极性分子;⑥SO2是V形,是极性分子;⑦SO3是平面三角形,是非极性分子;⑧PCl3是三角锥形,是极性分子,因此属于非极性分子的是①③④⑦;(5) 氯酸分子中非羟基氧原子个数小于高氯酸中非羟基氧原子个数,因此氯酸的酸性小于高氯酸;同样磷酸的酸性强于亚磷酸。

 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
