题目内容
标准状况下V L的HCl气体溶解在1 L水中(水的密度近似为1 g/mL),所得溶液的密度为ρ g/mL,质量分数为ω,物质的量浓度为c mol/L,则下列关系中不正确的是
- A.c=1000Vρ/(36.5V+22400)
- B.ω=36.5V/(36.5V+22400)
- C.ω=36.5c/(1000ρ)
- D.ρ=(36.5V+22400)/(22.4+22.4V)
试题分析:A、标准状况下VLHCl溶解在1L水中,所得溶液的质量为 [(V/22.4)×36.5+1000]g,因此所得溶液的体积为{[(V/22.4)×36.5+1000]/ ρ}mL="{[(V/22.4)×36.5+1000]/1000" ρ}L,所得溶液中溶质的物质的量="(V/22.4)" mol,则所得溶液的物质浓度为(V/22.4)/{[ (V/22.4) ×36.5+1000]/ 1000ρ}=1000Vρ/(36.5V+22400);故A正确;
B、标准状况下VLHCl溶解在1L水中,所得溶液中溶质质量为(V/22.4)×36.5 g,则所得溶液的质量分数为ω="[(V/22.4)×36.5]/[" [(V/22.4) ×36.5+1L×1000×1g/mL] =36.5V/(36.5V+22400);故B正确;
C、标准状况下VLHCl溶解在1L水中,所得溶液的体积为1L,所得溶液中溶质质量="1L×c" mol/L×36.5g/mol="36.5c" g,所得溶液的质量="1L×1000×ρ" g/mL="1000ρ" g,则所得溶液的溶质质量分数=36.5c/1000ρ;故C正确;
D、标准状况下VLHCl溶解在1L水中,所得溶液的质量为(V/22.4)×36.5+1L×1000×1g/mL=[(V/22.4)×36.5+1000]g,所得溶液的体积为1L=1000mL,则所得溶液的密度ρ="[" (V/22.4) ×36.5+1000]/1000=(36.5V+22400)/22400;故D不正确;故选D。
考点:有关溶质质量分数的简单计算
点评:标准状况下,每1mol的气体的体积为22.4L,利用这一关系由气体体积求得气体的物质的量、物质的质量,此为本问题分析中所需使用的关系。

在一固定容积的密闭容器中进行着如下反应:
CO2(g) + H2(g)  CO(g) + H2O(g),其平衡常数K和温度t的关系如下:
CO(g) + H2O(g),其平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(2) 能判断该反应是否已经达到化学平衡状态的是:
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正= v(H2O)逆 D.c(CO2) = c(CO)
(3)某研究小组利用反应:CO(g)+H2O(g)
 H2(g)+CO2(g) △H=-41.2kJ/mol,制备CO2与H2的混合气体。用碱液吸收一定量CO2的方法来提高混合气中H2与CO2的体积比。若以1L1.5mol/L的NaOH溶液充分吸收了22.4L(已折算为标准状况下体积)CO2,则吸收后溶液中各离子浓度从大到小的顺序是 。
H2(g)+CO2(g) △H=-41.2kJ/mol,制备CO2与H2的混合气体。用碱液吸收一定量CO2的方法来提高混合气中H2与CO2的体积比。若以1L1.5mol/L的NaOH溶液充分吸收了22.4L(已折算为标准状况下体积)CO2,则吸收后溶液中各离子浓度从大到小的顺序是 。(4)如将H2与CO2以4:1的体积比混合,在适当的条件下可制得CH4。已知:
CH4 (g) + 2O2(g)
 CO2(g)+ 2H2O(1) ΔH1=-890.3 kJ/mol
CO2(g)+ 2H2O(1) ΔH1=-890.3 kJ/mol H2(g) + 1/2O2(g)
 H2O(1) ΔH2=-285.8 kJ/mol
H2O(1) ΔH2=-285.8 kJ/mol 则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是 。
(5)熔融盐燃料电池如下图:
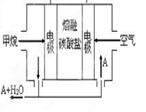
该图是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是CH4 +4CO32--8e-=5CO2+2H2O。正极的电极反应是_______ 。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环,则A物质的化学式是_________。实验过程中,若通入了标准状况下空气448L(假设空气中O2体积分数为20%),则熔融盐燃料电池消耗标准状况下CH4____________L。
在一固定容积的密闭容器中进行着如下反应:
CO2(g) + H2(g)  CO(g) + H2O(g),其平衡常数K和温度t的关系如下:
CO(g) + H2O(g),其平衡常数K和温度t的关系如下:
|
t℃ |
700 |
800 |
850 |
1000 |
1200 |
|
K |
2.6 |
1.7 |
1.0 |
0.9 |
0.6 |
(1) K的表达式为: ;该反应的正反应为 反应(“吸热”或“放热”)
(2) 能判断该反应是否已经达到化学平衡状态的是:
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正= v(H2O)逆 D.c(CO2) = c(CO)
(3)某研究小组利用反应:CO(g)+H2O(g)  H2(g)+CO2(g) △H=-41.2kJ/mol,制备CO2与H2的混合气体。用碱液吸收一定量CO2的方法来提高混合气中H2与CO2的体积比。若以1L1.5mol/L的NaOH溶液充分吸收了22.4L(已折算为标准状况下体积)CO2,则吸收后溶液中各离子浓度从大到小的顺序是 。
H2(g)+CO2(g) △H=-41.2kJ/mol,制备CO2与H2的混合气体。用碱液吸收一定量CO2的方法来提高混合气中H2与CO2的体积比。若以1L1.5mol/L的NaOH溶液充分吸收了22.4L(已折算为标准状况下体积)CO2,则吸收后溶液中各离子浓度从大到小的顺序是 。
(4)如将H2与CO2以4:1的体积比混合,在适当的条件下可制得CH4。已知:
CH4 (g) + 2O2(g)  CO2(g)+ 2H2O(1) ΔH1=-890.3 kJ/mol
CO2(g)+ 2H2O(1) ΔH1=-890.3 kJ/mol
H2(g) + 1/2O2(g)  H2O(1) ΔH2=-285.8 kJ/mol
H2O(1) ΔH2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是 。
(5)熔融盐燃料电池如下图:
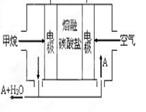
该图是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是CH4 +4CO32--8e-=5CO2+2H2O。正极的电极反应是_______ 。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环,则A物质的化学式是_________。实验过程中,若通入了标准状况下空气448L(假设空气中O2体积分数为20%),则熔融盐燃料电池消耗标准状况下CH4____________L。
(14分) 研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)利用反应6NO2+8NH3  7N2+12H2O可处理NO2。当转移3.6mol电子时,生成的N2在标准状况下是
L。
7N2+12H2O可处理NO2。当转移3.6mol电子时,生成的N2在标准状况下是
L。
(2)已知:反应1:2SO2(g)+O2(g) 2SO3(g) ΔH = —196.6 kJ·mol-1
2SO3(g) ΔH = —196.6 kJ·mol-1
反应2:NO2(g)+SO2(g) SO3(g)+NO(g) ΔH = —41.8kJ·mol-1
SO3(g)+NO(g) ΔH = —41.8kJ·mol-1
则反3:2NO(g)+O2(g) 2NO2(g)的 ΔH
= _________ kJ·mol-1
2NO2(g)的 ΔH
= _________ kJ·mol-1
(3) 一定条件下,将2molNO与2molO2置于恒容密闭容器中发生上述反应3,下列各项能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗1 molO2同时生成2 molNO2
(4)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),达平衡后测得各组分浓度如下:
CH3OH(g),达平衡后测得各组分浓度如下:
|
物质 |
CO |
H2 |
CH3OH |
|
浓度(mol•L—1) |
0.9 |
1.0 |
0.6 |
①混合气体的平均相对分子质量__________________________。
②列式并计算平衡常数K=__________________________。
③若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是__________。
④若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正___v逆(填“>”、“<”或“=”)。
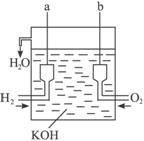
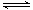 H2(g)+CO2(g)
△H=-41.2kJ/mol ,制备CO2与H2 的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
H2(g)+CO2(g)
△H=-41.2kJ/mol ,制备CO2与H2 的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。