题目内容
(11分)超细氧化铝是一种重要的功能陶瓷原料。
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式 。
(2)NH4Al(SO4)2?12H2O的相对分子质量为453。欲配制100mLPH为2、浓度约为0.1mol-1的NH4Al(SO4)2溶液,配制过程为
①用托盘天平称量NH4Al(SO4)2?12H2O固体 g;
②将上述固体置于烧杯中 。
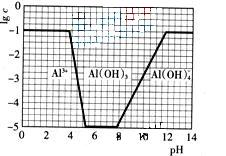
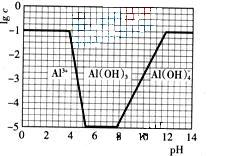
(3)在0.1mol?L-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液PH变化的关系见下图
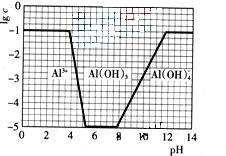
①用NaOH溶液调节(2)中溶液PH至7,该过程中发生反应的离子方程式有 。
②请在答题卡的框图中,画出0.01mol?L-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液PH变化的关系图,并进行必要的标注。
(1)2NH4AlO(OH)HCO3![]() Al2O3+3H2O+2CO2↑+2NH3↑
Al2O3+3H2O+2CO2↑+2NH3↑
(2)①4.5g;②再向烧杯中加入100mL蒸馏水,充分搅拌至固体溶解
(3)① H++OH-=H2O NH4++ OH―= NH3?H2O Al3++3OH―=Al(OH)3↓;
②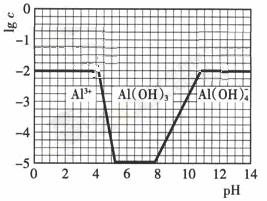
解析:
(1)根据NH4AlO(OH)HCO3组成联系到碳酸氢铵盐的分解可知:2NH4AlO(OH)HCO3![]() Al2O3+3H2O+2CO2↑+2NH3↑;
Al2O3+3H2O+2CO2↑+2NH3↑;
(2)由物质的量浓度的定义公式可计算:
m(NH4Al(SO4)2?12H2O)=n?M(NH4Al(SO4)2?12H2O)=c?V?M(NH4Al(SO4)2?12H2O)=0.1mol/L×100mL×10-3×453g/mol=4.53g,由于托盘天平的精确度为0.1g,故为4.5g;
(3)①由图像可知,开始阶段c(Al3+)没变化;而后c(Al3+)降低,生成Al(OH)3沉淀;当pH>8,Al(OH)3沉淀开始溶解。调节pH至7,OH―先跟NH4+反应,然后与Al3+反应生成Al(OH)3沉淀。

 (2009?广东)超细氧化铝是一种重要的功能陶瓷原料.
(2009?广东)超细氧化铝是一种重要的功能陶瓷原料. Al2O3+3H2O↑+2CO2↑+2NH3↑
Al2O3+3H2O↑+2CO2↑+2NH3↑
 (1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式
。
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式
。