题目内容
16.一定量的Fe与过量的稀硫酸反应,为了减缓反应速率又不影响生成氢气的总量,不可以采取的措施是( )| A. | 加入K2SO4溶液 | B. | 加入CH3COONa固体 | ||
| C. | 加一定量水 | D. | 加入KNO3溶液 |
分析 硫酸过量,减小氢离子的浓度,不改变铁的量,可满足减缓反应速率但又不影响生成H2的总量,以此来解答
解答 解:A.加入K2SO4溶液,氢离子浓度减小,反应速率减小,但生成氢气的量不变,故A正确;
B.加入CH3COONa固体,生成醋酸,氢离子浓度减小,反应速率减小,但生成氢气的量不变,故B正确;
C.加一定量水,氢离子浓度减小,反应速率减小,但生成氢气的量不变,故C正确;
D.加入KNO3溶液,酸性条件下,硝酸根离子具有强氧化性,与铁反应生成NO气体,故D错误.
故选D.
点评 本题考查影响化学反应速率的因素,注意强酸转化为弱酸时氢离子的浓度变小而总物质的量不变是解答本题的关键,并熟悉物质之间的反应来解答,题目难度不大.

练习册系列答案
相关题目
6.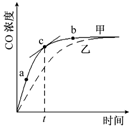 已知反应Al2O3(s)+3C(s)+N2(g)?2AlN(s)+3CO(g)在温度、容积恒定的密闭容器中进行,其中CO浓度随时间的变化关系如图曲线甲所示.下列说法不正确的是( )
已知反应Al2O3(s)+3C(s)+N2(g)?2AlN(s)+3CO(g)在温度、容积恒定的密闭容器中进行,其中CO浓度随时间的变化关系如图曲线甲所示.下列说法不正确的是( )
 已知反应Al2O3(s)+3C(s)+N2(g)?2AlN(s)+3CO(g)在温度、容积恒定的密闭容器中进行,其中CO浓度随时间的变化关系如图曲线甲所示.下列说法不正确的是( )
已知反应Al2O3(s)+3C(s)+N2(g)?2AlN(s)+3CO(g)在温度、容积恒定的密闭容器中进行,其中CO浓度随时间的变化关系如图曲线甲所示.下列说法不正确的是( )| A. | 从a、b两点坐标可求得从a到b时间间隔内该化学反应的平均速率 | |
| B. | c点切线的斜率表示该化学反应在t时刻的瞬时速率 | |
| C. | 在不同时刻都存在关系:3v(N2)=v(CO) | |
| D. | 维持温度、容积不变,若减少N2的物质的量进行反应,曲线甲将转变为曲线乙 |
8.向含2mol NaOH、1mol Ba(OH)2、2mol Na[Al(OH)4]的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量的关系不正确的是( )
| 选项 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 6 |
| n(沉淀)(mol) | 1 | 2 | 3 | 2 |
| A. | A | B. | B | C. | C | D. | D |
5.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1mol Cl2与过量的铁反应,转移2NA个电子 | |
| B. | 1mol ${\;}_{92}^{235}$U核素含有235NA个中子 | |
| C. | 1mol N2与3mol H2混合充分反应,转移的电子数目为6NA | |
| D. | 常温下,0.1mol/L的NH4NO3溶液中氮原子数为0.2NA |
6.如图所示的某有机反应,其反应类型为( )
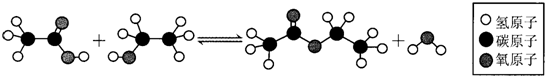

| A. | 取代反应 | B. | 加成反应 | C. | 水解反应 | D. | 氧化反应 |
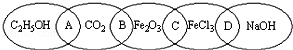 如图为五个椭圆交叉构成的图案,椭圆内分别写C2H5OH、CO2、Fe2O3、FeCl3和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号.请回答下列问题:
如图为五个椭圆交叉构成的图案,椭圆内分别写C2H5OH、CO2、Fe2O3、FeCl3和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号.请回答下列问题: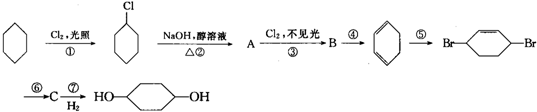
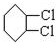 ,C
,C
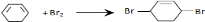 .
.