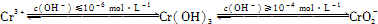题目内容
一定量的Fe和Fe2O3的混合物投入250mL 6.00mol/L的HNO3溶液中加热,固体完全溶解后,生成标准状况下气体1.12L(NO和NO2).再向反应后的溶液中加入2.00mol/L的NaOH溶液,要使铁元素完全沉淀下来,所加入的NaOH溶液的体积至少为( )
| A、无法确定 | B、700mL | C、750mL | D、725mL |
分析:反应中硝酸体现两种性质,一是酸性,以NO3-离子存在溶液中,另一种是氧化性,被还原为NOx,加入NaOH后使铁元素完全沉淀下来,此时溶液的溶质为硝酸钠,根据N元素守恒可知n(NaOH)=n(NO3-)=n(HNO3)-n(NOx),再根据V=
计算.
| n |
| c |
解答:解:当所加入的NaOH恰好使铁元素沉淀,此时溶液为硝酸钠溶液,根据N元素守恒:n(NaOH)=n(NO3-)=n(HNO3)-n(NOx)=0.25L×6mol/L-
=1.45mol,所以V(NaOH)=
=0.725L=725ml,故选D.
| 1.12L |
| 22.4L/mol |
| 1.45mol |
| 2.00mol/L |
点评:本题考查有关混合物的计算,题目难度中等,判断溶液中溶质为硝酸钠是关键,再利用N原子守恒计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
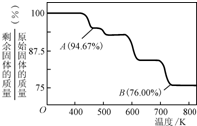 含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.