题目内容
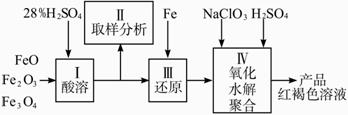
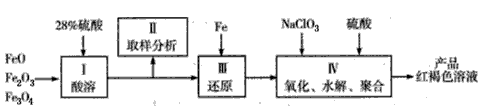
硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂, 广泛用于水的处理,用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+ 的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+ 。
实验步骤如下:
实验步骤如下:
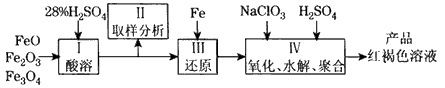
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有_________。
a. 玻璃棒 b.烧杯 c.烧瓶
(2)步骤Ⅱ取样分析溶液中Fe2+ 、Fe3+的含量,目的是_______和确定氧化Fe2+所需NaClO3的量:
a. 控制溶液中Fe2+与Fe3+含量比
b. 确保铁的氧化物酸溶解完全
c. 确定下一步还原所需铁的量
(3)完成步骤Ⅳ中的氧化还原反应:补充产物并配平:
_____Fe2+ +____ClO3-+_____H+=_____Fe3+ +______Cl-+______
(4)聚合硫酸铁溶液中SO42-与Fe3+物质的量之比不是3:2。根据下列提供选 择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42-与Fe3+物质的量之比。 测定时所需的试剂____。
a.NaOH b.FeSO4 c.BaCl2 d.NaClO3
需要测定Fe2O3和____的质量(填写化合物的化学式)。
a. 玻璃棒 b.烧杯 c.烧瓶
(2)步骤Ⅱ取样分析溶液中Fe2+ 、Fe3+的含量,目的是_______和确定氧化Fe2+所需NaClO3的量:
a. 控制溶液中Fe2+与Fe3+含量比
b. 确保铁的氧化物酸溶解完全
c. 确定下一步还原所需铁的量
(3)完成步骤Ⅳ中的氧化还原反应:补充产物并配平:
_____Fe2+ +____ClO3-+_____H+=_____Fe3+ +______Cl-+______
(4)聚合硫酸铁溶液中SO42-与Fe3+物质的量之比不是3:2。根据下列提供选 择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42-与Fe3+物质的量之比。 测定时所需的试剂____。
a.NaOH b.FeSO4 c.BaCl2 d.NaClO3
需要测定Fe2O3和____的质量(填写化合物的化学式)。
(1)ab
(2)C
(3) 6Fe2+ +ClO3-+6H+=6Fe3+ +Cl-+3H2O
(4)ac ;BaSO4
(2)C
(3) 6Fe2+ +ClO3-+6H+=6Fe3+ +Cl-+3H2O
(4)ac ;BaSO4

练习册系列答案
相关题目

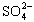 与Fe3+物质的量之比不是3∶2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中
与Fe3+物质的量之比不是3∶2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中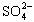 与Fe3+物质的量之比。?
与Fe3+物质的量之比。?