题目内容
(2013?洛阳一模)短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10.A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数.则下列叙述正确的是( )
分析:A与C同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数,设A的最外层电子数为x,若B为第二周期元素,则2x=2,x=1,则A为H,B与D同主族,原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10,B为C,C为Na,D为Si,它们的核电荷数1+6+11+14=32,符合题意;若B为第三周元素,则2x=8,x=4,A为碳,C为硅,B和D找不出符合题意的元素,
A、根据D为硅,利用电子排布来分析其位置;
B、利用电子层数越多,半径越大,在同一周期从左到右原子半径在减小来分析;
C、二氧化碳是分子晶体,而二氧化硅中是原子晶体;
D、高温下,碳与二氧化硅能发生反应,常温下钠与水反应.
A、根据D为硅,利用电子排布来分析其位置;
B、利用电子层数越多,半径越大,在同一周期从左到右原子半径在减小来分析;
C、二氧化碳是分子晶体,而二氧化硅中是原子晶体;
D、高温下,碳与二氧化硅能发生反应,常温下钠与水反应.
解答:解:A与C同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数,设A的最外层电子数为x,若B为第二周期元素,则2x=2,x=1,则A为H,B与D同主族,原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10,B为C,C为Na,D为Si,它们的核电荷数1+6+11+14=32,符合题意;
A、因硅有3个电子层,最外层电子数为4,则在周期表中的第三周期第ⅣA族,故A错误;
B、电子层数越多,半径越大,在同一周期从左到右原子半径在减小,则半径关系为C>D>B>A,故B错误;
C、二氧化碳是分子晶体,而二氧化硅中是原子晶体,物理性质不同,故C错误;
D、因C+SiO2
Si+2CO↑,2Na+2H20═2NaOH+H2↑,即B单质能置换出D单质,C单质能置换出A单质,故D正确;
故选D.
A、因硅有3个电子层,最外层电子数为4,则在周期表中的第三周期第ⅣA族,故A错误;
B、电子层数越多,半径越大,在同一周期从左到右原子半径在减小,则半径关系为C>D>B>A,故B错误;
C、二氧化碳是分子晶体,而二氧化硅中是原子晶体,物理性质不同,故C错误;
D、因C+SiO2
| ||
故选D.
点评:本题考查学生利用原子结构的关系来推断元素,然后利用元素的电子排布分析位置及半径,利用物质的结构和性质来分析解答问题,推断元素是解答本题的难点,应学会利用假设和验证的方法来解答,题目难度中等.

练习册系列答案
相关题目
 (2013?洛阳一模)化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8min间的平均反应速率和推测反应16min时反应物的浓度,结果应是( )
(2013?洛阳一模)化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8min间的平均反应速率和推测反应16min时反应物的浓度,结果应是( )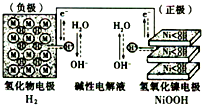 (2013?洛阳一模)“天宫一号”飞行器在太空工作期间必须有源源不断的电源供应.其供电原理是:白天太阳能帆板发电,将一部分电量直接供给天宫一号,另一部分电量储存在镍氢电池里,供黑夜时使用.如图为镍氢电池构造示意图(氢化物电极为储氢金属,可看做H2直接参加反应).下列说法正确的是( )
(2013?洛阳一模)“天宫一号”飞行器在太空工作期间必须有源源不断的电源供应.其供电原理是:白天太阳能帆板发电,将一部分电量直接供给天宫一号,另一部分电量储存在镍氢电池里,供黑夜时使用.如图为镍氢电池构造示意图(氢化物电极为储氢金属,可看做H2直接参加反应).下列说法正确的是( )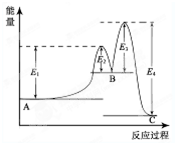 (2013?洛阳一模)某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示能量).下列有关叙述正确的是( )
(2013?洛阳一模)某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示能量).下列有关叙述正确的是( )