题目内容
(2009?中山模拟)有 Fe3+﹑Fe2+﹑NO3-﹑NH4+﹑H+和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
分析:Fe2+具有还原性,NO3-在酸性条件下具有强氧化性,由题意可以确定,铁元素的化合价升高,N元素的化合价降低,则发生反应8Fe2++NO3-+10H+=8Fe3++NH4++H2O.
A、该反应中氧化剂是NO3-,还原剂是Fe2+,结合方程式判断氧化剂与还原剂的物质的量之比.
B、氧化剂通过还原反应生成的产物为还原产物.反应中N元素的化合价由NO3-中+5价降低为NH4+中-3价.
C、反应中N元素的化合价由NO3-中+5价降低为NH4+中-3价,据此计算有lmolNO3- 发生还原反应,转移电子数.
D、原电池负极发生氧化反应,Fe2+在负极放电生成Fe3+.
A、该反应中氧化剂是NO3-,还原剂是Fe2+,结合方程式判断氧化剂与还原剂的物质的量之比.
B、氧化剂通过还原反应生成的产物为还原产物.反应中N元素的化合价由NO3-中+5价降低为NH4+中-3价.
C、反应中N元素的化合价由NO3-中+5价降低为NH4+中-3价,据此计算有lmolNO3- 发生还原反应,转移电子数.
D、原电池负极发生氧化反应,Fe2+在负极放电生成Fe3+.
解答:解:Fe2+具有还原性,NO3-在酸性条件下具有强氧化性,由题意可以确定,铁元素的化合价升高,N元素的化合价降低,则发生反应8Fe2++NO3-+10H+=8Fe3++NH4++H2O.
A、由方程式可知该反应中氧化剂(NO3-)与还原剂(Fe2+)物质的量之比为1:8,故A错误;
B、反应中N元素的化合价由NO3-中+5价降低为NH4+中-3价,NH4+是还原产物,故B正确;
C、反应中N元素的化合价由NO3-中+5价降低为NH4+中-3价,所以有lmolNO3- 发生还原反应,转移电子数为1mol×[5-(-3)]=8mol,故C正确;
D、原电池负极发生氧化反应,Fe2+在负极放电生成Fe3+,若把该反应设计成原电池,负极反应为Fe2+-e-=Fe3+,故正确.
故选:A.
A、由方程式可知该反应中氧化剂(NO3-)与还原剂(Fe2+)物质的量之比为1:8,故A错误;
B、反应中N元素的化合价由NO3-中+5价降低为NH4+中-3价,NH4+是还原产物,故B正确;
C、反应中N元素的化合价由NO3-中+5价降低为NH4+中-3价,所以有lmolNO3- 发生还原反应,转移电子数为1mol×[5-(-3)]=8mol,故C正确;
D、原电池负极发生氧化反应,Fe2+在负极放电生成Fe3+,若把该反应设计成原电池,负极反应为Fe2+-e-=Fe3+,故正确.
故选:A.
点评:本题考查氧化还原反应、原电池等,难度中等,根据反应物和生成物结合物质的性质书写该反应的离子方程式是解答关键.

练习册系列答案
相关题目
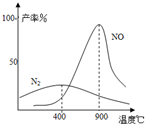 (2009?中山模拟)工业合成氨与制备硝酸一般可连续生产,流程如下:
(2009?中山模拟)工业合成氨与制备硝酸一般可连续生产,流程如下: