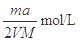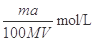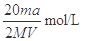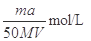题目内容
Ⅰ.短周期元素R被称为“生命元素”,R元素的最价高氧化物对应的水化物能与其气态氢化物化合生成盐A,写出生成A的化学方程式 。
Ⅱ.将一定量Mg、Al合金溶于40 mL的H2SO4溶液中,然后向所得溶液中滴加1 mol·L-1 的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液(mL)体积的关系如图所示。
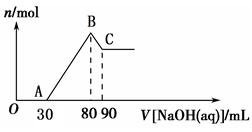
(1)合金中Mg、Al的物质的量之比为 ________。
(2)所加硫酸的物质的量浓度为__________。
Ⅱ.将一定量Mg、Al合金溶于40 mL的H2SO4溶液中,然后向所得溶液中滴加1 mol·L-1 的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液(mL)体积的关系如图所示。

(1)合金中Mg、Al的物质的量之比为 ________。
(2)所加硫酸的物质的量浓度为__________。
(10分)
Ⅰ. NH3+HNO3==NH4NO3 ------ 3分
Ⅱ. (1) 1:1 3分 (2) 1 mol·L-1 4分
说明:化学方程式不配平不得分,化学式、关键字、罗马数字写错、元素符号严重不规范、答案写错位置不得分;漏条件、‘浓’字扣1分;不写‘↑’不扣分。
Ⅰ. NH3+HNO3==NH4NO3 ------ 3分
Ⅱ. (1) 1:1 3分 (2) 1 mol·L-1 4分
说明:化学方程式不配平不得分,化学式、关键字、罗马数字写错、元素符号严重不规范、答案写错位置不得分;漏条件、‘浓’字扣1分;不写‘↑’不扣分。
试题分析:Ⅰ. R为N元素,其最价高氧化物对应的水化物为HNO3,氢化物为NH3,反应生成A的化学方程式为NH3+HNO3==NH4NO3。
Ⅱ.Ⅱ. (1)B→C过程是沉淀Al(OH)3溶解的过程,发生反应的离子方程式为Al(OH)3+OH-═AlO2-+H2O,消耗的NaOH溶液为0.01mol,根据方程式计算Al(OH)3为0.01mol,根据质量守恒定律得Al为0.01mol。A→B过程为生成Mg(OH)2和Al(OH)3的过程,发生反应的离子方程式为Mg2++2OH-= Mg(OH)2↓,Al3++3OH-= Al(OH)3↓,消耗NaOH溶液为0.05mol,根据方程式计算,Al为0.01mol,即Al3+消耗NaOH溶液为0.03mol,则Mg2+消耗NaOH溶液为0.02mol,即Mg2+为0.01mol。根据根据质量守恒定律得Mg为0.01mol。故合金中Mg、Al的物质的量之比为1:1。
(2)Mg、Al合金消耗硫酸的物质的量为0.01mol+0.015mol=0.025mol,根据图像分析,硫酸消耗NaOH溶液为0.03mol,硫酸的物质的量为0.15mol。总硫酸的物质的量为0.04mol故所加硫酸的物质的量浓度为0.04mol÷0.04L=1mol/L。
点评:本题考查镁铝混合物的计算,题目难度不大,注意分析图象曲线的意义,根据物质的性质结合化学方程式计算。

练习册系列答案
相关题目
 的浓度最大的是( )
的浓度最大的是( )