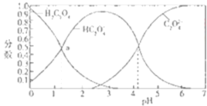
题目内容
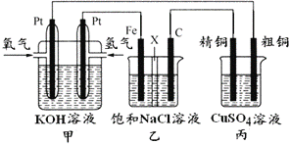
【题目】如图所示,某同学设计一个燃料电池并探究氯碱工业原理和电解CuSO4溶液,其中乙装置中X为阳离子交换膜。
根据要求回答相关问题:
(1)通入氧气的电极为___(填“正极”或“负极”),负极的电极反应式为___。
(2)铁电极为___(填“阳极”或“阴极”),石墨电极(C)的电极反应式为___。
(3)乙装置中电解的总反应的离子方程式为___。
(4)若在标准状况下,有1.12L氧气参加反应,丙装置中阴极增重的质量为___。
【答案】正极 H2-2e-+2OH-=2H2O 阴极 2Cl--2e-=Cl2↑ 2Cl-+2H2O![]() H2↑+Cl2↑+2OH- 6.4g
H2↑+Cl2↑+2OH- 6.4g
【解析】
(1)燃料电池是将化学能转变为电能的装置,属于原电池,通入燃料的电极是负极,负极上燃料失电子发生氧化反应,据此分析解答;
(2)电解饱和氯化钠溶液时,连接原电池负极的电极是阴极,连接原电池正极的电极是阳极,阳极上氯离子放电,阴极上氢离子放电,注意如果活泼电极作阳极,则阳极上电极材料放电而不是溶液中阴离子放电;
(3)乙装置阳极为惰性电极电解饱和氯化钠溶液,据此写出电解总反应;
(4)丙装置中阴极增重的质量为析出铜的质量,串联电池中转移电子数相等,根据转移电子数相等计算丙装置中阴极析出铜的质量。
(1)燃料电池是将化学能转变为电能的装置,属于原电池,通入燃料的电极是负极,通入空气或氧气的电极是正极,所以通入氧气的电极是正极,负极上氢气失电子结合溶液中的氢氧根离子生成水,电极反应式为:H2-2e-+2OH-=2H2O,故答案为:正极,H2-2e-+2OH-=2H2O;
(2)燃料电池相当于电源,乙装置有外接电源属于电解池,铁电极连接原电池的负极,所以是阴极,则石墨电极是阳极,阳极上氯离子放电生成氯气,电极反应式为:2Cl--2e-═Cl2↑,故答案为:阴极;2Cl--2e-═Cl2↑;
(3)乙装置是阳极为惰性电极的电解饱和氯化钠溶液电解池,阳极氯离子放电生成氯气,阴极水电离出的氢离子放电生成氢气,则电解总反应离子方程式为2Cl-+2H2O ![]() 2OH-+Cl2↑+H2↑,故答案为:2Cl-+2H2O
2OH-+Cl2↑+H2↑,故答案为:2Cl-+2H2O ![]() 2OH-+Cl2↑+H2↑;
2OH-+Cl2↑+H2↑;
(4)丙装置中阴极增重的质量为析出铜的质量,根据串联电池中转移电子数相等得氧气和铜的关系式为:O2~2H2~2Cu,设生成铜的质量是y,
O2~~~2Cu
22.4L 128g
1.12L y
![]() =
=![]() ,解得:y=6.4g,故答案为:6.4g。
,解得:y=6.4g,故答案为:6.4g。

【题目】对FeC13溶液与KI溶液反应进行探究实验,按选项ABCD顺序依次进行操作,依据现象,所得结论错误的是
操作 | 现象 | 结论 | |
A | 取2mL 0.1molL-1KI溶液于试管中,滴加3滴0.1molL-1FeCl3溶液,振荡,充分反应。将所得溶液分别置于试管①和试管②中 | 溶液呈深棕黄色 | FeCl3与KI反应,生成了I2 |
B | 向试管①中滴加2滴0.1molL-1 KSCN溶液 | 溶液显红色 | FeCl3与KI反应具有可逆性 |
C | 向试管②中加入1mLCCl4,充分振荡,静置 | 溶液分层,上层为浅棕黄色,下层为紫色 | 上层溶液为浅棕黄色,证明有Fe3+剩余 |
D | 取试管②的上层液体置于试管③中,滴加0.1molL-1 KSCN溶液 | 溶液显浅红色 | 试管③中红色比试管①中浅,是平衡移动的结果 |
A.AB.BC.CD.D