题目内容
金属镁在氮气中燃烧生成Mg3N2,它与水反应生成NH3和Mg(OH)2。请回答以下问题:
(1)Mg3N2的电子式可表示为____________________,由________键组成。
(2)Mg3N2与盐酸反应生成_______种盐,分别为_______________________________。
(3)NH4Cl的电子式为______________________,NH5的电子式为_________________。
(4)r(N3—)________r(Mg2+)(填“>”、“=”或“<”)=
【答案】
(1)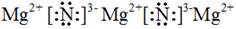 离子 (2)两 MgCl2、NH4Cl
离子 (2)两 MgCl2、NH4Cl
(3)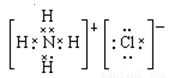 、
、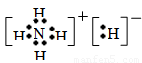 (4)>
(4)>
【解析】
试题分析:(1)氮元素和镁元素都是活泼的金属元素和活泼的非金属元素,因此Mg3N2是离子化合物,形成离子键,其电子式是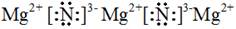 。
。
(2)Mg3N2与水反应生成NH3和Mg(OH)2,所以和盐酸反应生成的是氯化铵和氯化镁,共计是两种盐。
(3)氯化铵是离子化合物,电子式是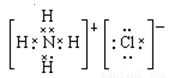 ;NH5与NH4Cl类似,即该化合物的电子式是
;NH5与NH4Cl类似,即该化合物的电子式是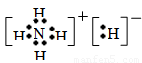 。
。
(4)核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,所以r(N3—)>r(Mg2+)。
考点:考查化学键的判断、电子式的书写以及微粒半径的比较
点评:该题是中等难度的试题,试题基础性强,但更侧重对学生能力的考查,难易适中。本题有利于培养学生的逻辑推理能力,以及知识的迁移能力。有利于调动学生的学习积极性,提高学生的学习兴趣。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目