题目内容
13.高温下,某反应达平衡,平衡常数K=$\frac{c(X)•c(Y)}{c(M)•c(N)}$.恒容时,温度升高,N浓度减小,下列说法正确的是( )| A. | 该反应化学方程式为X(g)+Y(g)?M(g)+N(g) | |
| B. | 恒温恒容下,增大压强,N浓度一定减小 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 该反应的焓变△H>0 |
分析 A.K为生成物浓度幂之积与反应物浓度幂之积的比;
B.恒温恒容下,增大压强,平衡向气体体积减小的方向移动;
C.升高温度,加快反应速率;
D.温度升高,N浓度减小,可知升高温度,平衡正向移动.
解答 解:A.由平衡常数K=$\frac{c(X)•c(Y)}{c(M)•c(N)}$,可知反应为M(g)+N(g)?X(g)+Y(g),故A错误;
B.M(g)+N(g)?X(g)+Y(g)为气体体积不变的反应,增大压强,平衡不移动,N的浓度不变,故B错误;
C.升高温度,加快反应速率,正逆反应速率均增大,故C错误;
D.温度升高,N浓度减小,可知升高温度,平衡正向移动,则反应的焓变△H>0,故D正确;
故选D.
点评 本题考查化学平衡,为高频考点,把握K的意义、温度对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意选项B为解答的易错点,题目难度不大.

练习册系列答案
相关题目
15.取一定量的镁铝合金均分为两份,分别与足量的盐酸、NaOH溶液充分反应,产生气体的物质的量之比为5:3.合金与NaOH溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
4.下列关于实验描述正确的是( )
| A. | 向浓氨水中滴加饱和 FeCl3溶液,可以制得 Fe(OH)3胶体 | |
| B. | 为除去Mg(OH)2固体中少量Ca(OH)2,可用饱和 MgCl2溶液多次洗涤,再水洗、干燥 | |
| C. | 向溶液X中加入足量盐酸,产生无色无味气体,将气体通入澄清石灰水,产生白色沉 淀,说明溶液 X 中含有 CO32- | |
| D. | 卤代烃Y与NaOH醇溶液共热后,恢复至室温,再滴加AgNO3溶液,产生白色沉淀,说明卤代烃 Y 中含有氯原子 |
18. 有机物A、B均为合成某种抗支气管哮喘药物的中间体,如图所示,A在一定条件下可转化为B,下列说法错误的是( )
有机物A、B均为合成某种抗支气管哮喘药物的中间体,如图所示,A在一定条件下可转化为B,下列说法错误的是( )
 有机物A、B均为合成某种抗支气管哮喘药物的中间体,如图所示,A在一定条件下可转化为B,下列说法错误的是( )
有机物A、B均为合成某种抗支气管哮喘药物的中间体,如图所示,A在一定条件下可转化为B,下列说法错误的是( )| A. | 分子B中只含有3种官能团 | |
| B. | 分子A中所有碳原子不可能位于同一平面 | |
| C. | 分子B能发生银镜反应,但不能发生水解反应 | |
| D. | 用FeCl3溶液可检验物质B中是否混有A |
5.下列措施中,能减慢化学反应速率的是( )
| A. | 将食物存放在温度低的地方 | |
| B. | 将块状固体药品研细后再反应 | |
| C. | 用MnO2作H2O2分解反应的催化剂 | |
| D. | 用4 mol/LH2SO4溶液代替1 mol/LH2SO4溶液与锌粒反应 |
2.现有下列试剂:(1)氯水 (2)Br2水 (3)碘水 (4)碘酒 溶液,其中能使淀粉碘化钾溶液变蓝的是( )
| A. | 除(3)外 | B. | 除(4)外 | C. | 除(2)外 | D. | 全部 |
5.下列说法正确的是( )
| A. | 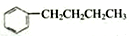 的与H2加成之后的产物中,其一氯代物有7种 的与H2加成之后的产物中,其一氯代物有7种 | |
| B. | CH3CH=CHCH3分子中的四个碳原子在同一直线上 | |
| C. | 按系统命名法,化合物 的名称是2,3,4-三甲基-2-乙基戊烷 的名称是2,3,4-三甲基-2-乙基戊烷 | |
| D. |  的一溴代物和 的一溴代物和  的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) |
