题目内容
7.在加热情况下能和浓H2SO4反应放出刺激性气味气体,并将气体通入水中呈酸性,通入溴水或酸性KMnO4溶液中,颜色都消失的物质是( )| A. | 氧化亚铁 | B. | 二氧化锰 | C. | 氧化铜 | D. | 木炭粉 |
分析 A、FeO与浓硫酸反应生成二氧化硫,反应不需要加热;
B、二氧化锰具有强氧化性,不与浓硫酸反应;
C、氧化铜是碱性氧化物溶于硫酸,不发生氧化还原反应;
D、木炭和浓硫酸加热反应放出二氧化硫气体,二氧化硫具有还原性被溴水、高锰酸钾溶于氧化;
解答 解:因为浓硫酸具有强氧化性,所以可与还原剂发生氧化还原反应,ABCD四个选项中AD具有还原性,BC具有氧化性,AD与浓硫酸反应时生成的二氧化硫具有还原性,通入水中生成亚硫酸,溶液呈酸性;通入溴水或酸性KMnO4溶液中,颜色都消失,但是FeO与浓硫酸反应不需要加热,反应的方程式为:2FeO+4H2SO4=Fe2(SO4)3+SO2↑+4H2O,碳与浓硫酸反应,反应需要加热,反应的化学方程式为:C+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
故选D.
点评 本题考查了浓硫酸性质分析,主要是氧化还原反应的产物分析和条件判断,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
17.下列物质中,分子的一端亲水,分子的另一端亲油的是( )
| A. | CH3Cl | B. | 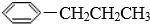 | C. | CH3(CH2)4COOCH3 | D. | CH3(CH2)13SO3Na |
18.下列各组离子能大量共存的是( )
| A. | Ba2+、Fe3+、OH-、Cl- | B. | Mg2+、Na+、Cl-、SO42- | ||
| C. | NH4+、Ba2+、NO3-、OH- | D. | H+、K+、NO3-、CO32- |
15.氯仿 (CHCl3)不溶于水,密度比水大,是一种良好的有机溶剂,若保存不当受到光照射时,易被氧化而产生剧毒光气(COCl2),同时生成HCl,下列有关氯仿变质的检验正确的是( )
| A. | 用蒸馏水检验氯仿是否变质 | |
| B. | 用硝酸银溶液检验氯仿是否变质 | |
| C. | 用氢氧化钠检验氯仿是否变质 | |
| D. | 用干燥的蓝色石蕊试纸检验氯仿是否变质 |
2.从下列叙述中,可以肯定金属A比金属B的活泼性强的是( )
| A. | A,B用导线连接后浸入电解质溶液,结果电子从B流向A | |
| B. | A从酸中置换出H2比B从酸中置换H2难 | |
| C. | 1 mol A从酸中置换出H十生成的H2比1mol B从酸中置换出H十生成的H2多 | |
| D. | 常温时,A能从水中置换出氢气,而B不能 |
12.与下列物质反应时,浓硫酸、稀硫酸中实际被消耗的成分不完全相同的是( )
| A. | Na2CO3 | B. | MgO | C. | Zn | D. | Ba(OH)2 |
19.下列对乙烯分子的叙述中错误的是( )
| A. | 乙烯分子里所有的原子在同一平面上 | |
| B. | 乙烯的结构简式为CH2CH2,电子式为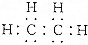 | |
| C. | 乙烯分子中碳氢键之间的夹角约为120° | |
| D. | 乙烯分子中既含有极性键又含有非极性键 |
11.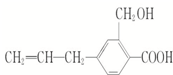 某有机物的结构简式为如右图所示,其可能具有的性质是( )
某有机物的结构简式为如右图所示,其可能具有的性质是( )
①能发生加成反应
②能使酸性高锰酸钾溶液褪色
③能发生取代反应
④能发生中和反应
⑤能发生氧化反应.
 某有机物的结构简式为如右图所示,其可能具有的性质是( )
某有机物的结构简式为如右图所示,其可能具有的性质是( ) ①能发生加成反应
②能使酸性高锰酸钾溶液褪色
③能发生取代反应
④能发生中和反应
⑤能发生氧化反应.
| A. | 全部 | B. | 仅能发生①②③④ | C. | 除⑤外都能 | D. | 除④⑤外都能 |
12.已知短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同的电子层结构,下列正确的是( )
| A. | 原子序数:a>b>c>d | B. | 离子的还原性:Y2->Z- | ||
| C. | 氢化物的稳定性H2Y>HZ | D. | 原子半径X<W |