��Ŀ����
����Ŀ����NAΪ����٤��������ֵ������˵����ȷ���ǣ� ��
A.0.2molAl������NaOH��Һ��Ӧ�����ɵ�H2������Ϊ0.3NA
B.�����£�1LpH=1��������Һ����ˮ�����H+������ĿΪ0.1NA
C.��״���£�0.1mol�ȷµ����Ϊ2.24L
D.11P4+60CuSO4+96H2O=20Cu3P+24H3SO4+60H2SO4��Ӧ�У�6molCuSO4���������ķ�����Ϊ1.1NA
���𰸡�A
���������⣺A��1mol����Ӧ����1.5mol��������0.2mol����Ӧ����0.3mol��������0.3NA���������ӣ���A��ȷ��B�������£�1LpH=1��������Һ�к��������ӵ����ʵ���Ũ��Ϊ��0.1mol/L������������ˮ�ĵ��룬����Һ�е�������������ˮ����ģ�ˮ�����������Ũ��Ϊ��1��10��13mol/L��1L����Һ����ˮ����������ӵ����ʵ���Ϊ��1��10��13mol����B����
C������£��ȷ�ΪҺ̬�����ܸ�������Ħ����������㣬��C����
D��CuԪ�صĻ��ϼ���+2�۽��͵�+1�ۣ�CuSO4����������P4������Ԫ����0�۽��͵���3�ۣ�������Ԫ����0�����ߵ�+5�ۣ���Ԫ�صĻ��ϼۼ������ֽ��ͣ�����P4�������������ǻ�ԭ��������11molP4�μӷ�Ӧ������5mol��P4����������60mol����ͭ����������ֻ��6mol��P4����ԭ����
���ɵ����غ��֪����6 mol��CuSO4�μӷ�Ӧ��������ͭ�����İ����ӵ����ʵ���Ϊ ![]() =
= ![]() mol����D����
mol����D����
��ѡA��

 �Ǽ�����������ϵ�д�
�Ǽ�����������ϵ�д� â���̸������Ծ�ϵ�д�
â���̸������Ծ�ϵ�д�����Ŀ��ijѧ����0.1000 molL��1KOHҺ�ζ�δ֪Ũ�ȵĴ��ᣬ������ֽ�Ϊ���¼����� A����ȡ20mL�������ע��ྻ����ƿ��������2��3��ָʾ��
B���ñ���Һ��ϴ�ζ���2��3��
C����ʢ�б���Һ�ļ�ʽ�ζ��̶ܹ��ã����ڵζ��ܼ���ʹ֮������Һ
D��ȡ��KOH���ʽ�ζ�������0���̶�����1��2cm
E������Һ������0����0������ijһ�̶ȣ����¶���
F������ƿ���ڵζ��ܵ����棬�ñ�KOH��Һ�ζ����յ㲢���µζ���Һ��Ŀ̶ȣ�
�ʹ�ʵ�������գ�
��1����ȷ���������˳���ǣ��������ĸ��д����
��2������B���������Ŀ������
��3������A�������֮ǰ�����ô���Һ��ϴ��ƿ��������յζ������Ӱ���� �� �����������С�������䡱��
��4��A�����У�ʹ�õ�ָʾ��Ϊ �� �жϵ���ζ��յ��ʵ�������ǣ���
��5����ͼ1Ϊijһ�μ�ʽ�ζ��ܵζ�ǰҺ�棬�����ֵΪmL��ͼ2Ϊ�ζ�����Һ�棬�εζ����̹�ʹ����mLKOH����Һ 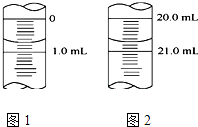
��6��Ϊ�궨ij������Һ��ȷŨ�ȣ���0.1000molL��1��NaOH��Һ��20.00mL������Һ���еζ������εζ�����NaOH��Һ��������£�
ʵ����� | 1 | 2 | 3 | 4 |
����NaOH��Һ�������mL�� | 20.05 | 20.00 | 18.80 | 19.95 |
��ô�����Һ��ȷŨ��Ϊ �� ������С�������λ��
����Ŀ���±���ijЩ��Ӧ����ʽ�����ۺ������ǣ� ��
��� | ���ӷ���ʽ��缫��Ӧʽ | ���� | |
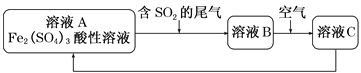
A | ���������Һ��ͨ������SO2 | Ca2++ClO��+SO2+H2O=CaSO4+Cl��+2H+ | ��ȷ |
B | ��������Һ������������Һ��� | Fe3++SO | ��ȷ |
C | ���������ˮ | CH3COO��+NH | ����������ˮ����ٽ���Ӧ���á�=���� |
D | �ö��Ե缫����Ȼ�ͭ���Ȼ��ƵĻ����Һһ��ʱ�� | ������2Cu2++4e��=2Cu | ��������������Ӧ������ͬʱ���� |
A.A
B.B
C.C
D.D