题目内容
下列关于生活中化学知识的叙述正确的是
A.“地沟油”禁止食用,但可以用来制肥皂
B.为提高农作物的产量和质量,应大量使用化肥和农药
C.加碘盐就是在食用盐中加入碘单质
D.大量焚烧稻草、小麦桔杆等不会对空气质量造成影响
【答案】
A
【解析】
试题分析:A、地沟油危害人体健康,不能食用,其主要成分为高级脂肪酸甘油酯,可以用来制肥皂,制肥皂,正确;B、化肥和农药会在农作物内产生残留,应适用使用,错误;C、加碘盐是在食用盐中加入了碘酸钾,错误;D、大量焚烧稻草、小麦桔杆,会产生
考点:本题考查化学与社会、生活。

练习册系列答案
相关题目



 TiCl4(1)+O2(g) △H=+151 kJ/mol。所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4,请说明判断该反应难以发生的理由是_______。当往氯化反应体系中加入碳后,反应在高温条件下能顺利进行生成TiCl4。
TiCl4(1)+O2(g) △H=+151 kJ/mol。所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4,请说明判断该反应难以发生的理由是_______。当往氯化反应体系中加入碳后,反应在高温条件下能顺利进行生成TiCl4。 394
kJ/mol。
394
kJ/mol。
 TiO2/S*
(激发态)
TiO2/S*
(激发态) TiO2/S+
+ e-
TiO2/S+
+ e- N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表:
N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表:
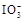 +5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在
+5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在 消毒,已知在消毒过程中,通过放电发生发如下反应:
消毒,已知在消毒过程中,通过放电发生发如下反应: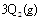

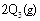 ;
;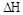
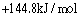 ;下列关于臭氧说法不正确的是(
)
;下列关于臭氧说法不正确的是(
)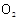 和
和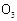 互为同素异形体
互为同素异形体