题目内容
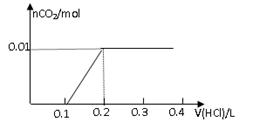
将0.8g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
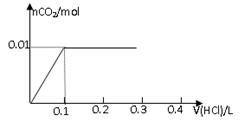
A B
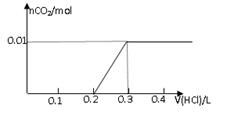
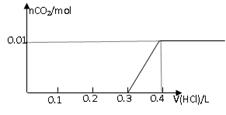
C D


A B


C D
D
试题分析:对NaOH和Na2CO3混合配成的溶液,当滴加盐酸时,先发生氢氧化钠与盐酸的中和反应,再发生碳酸钠与盐酸的反应生成碳酸氢钠和氯化钠,最后发生碳酸氢钠与盐酸反应才有二氧化碳气体生成,有关反应的方程式分别是NaOH+HCl=NaCl+H2O、HCl+Na2CO3=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑。0.8g NaOH和1.06g Na2CO3物质的量分别是0.8g÷40g/mol=0.02mol、1.06g÷106/mol=0.01mol,三步反应中消耗氯化氢的物质的量分别是0.02mol、0.01mol和0.01mol,对应盐酸的体积是0.2L、0.1L、0.1L,即盐酸的体积滴加到0.3L时开始出现气体,滴加到0.4L时气体达到最大值,因此选项D符合,答案选D。
点评:该题时高考中的常见题型,属于中等难度的试题,主要是考查了元素化合物、图象数据的处理知识。试题贴近高考,难易适中,有利于培养学生的逻辑推理能力和创新思维能力。解答此题的易错点是,不能准确理解向碳酸钠溶液中滴加盐酸的反应.是分步进行的,首先发生的是HCl+Na2CO3=NaHCO3+NaCl;进行完全后,再发生:NaHCO3+HCl=NaCl+H2O+CO2↑。

练习册系列答案
相关题目