题目内容
【题目】常温下,向20 mL 0.1 mol·L-1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是( )

A. 常温下,0.1 mol·L-1氨水中NH3·H2O的电离常数K约为1×10-5
B. a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. c点溶液中c(NH4+)=c(Cl-)
D. d点代表两溶液恰好完全反应
【答案】A
【解析】
A.常温下,0.1 mol·L-1的氨水溶液中c(H+)=10-11mol/L,则c(OH-)=![]() mol/L=0.001mol/L,Ka=
mol/L=0.001mol/L,Ka=![]() =
=![]() mol/L=1×10-5 mol/L,所以A选项是正确的;
mol/L=1×10-5 mol/L,所以A选项是正确的;
B.a、b之间的任意一点,溶液都呈碱性,则c(H+)< c(OH-),结合电荷守恒得c(Cl-)< c(NH4+),故B错误;
C.根据图知,c点c(H+)>10-7mol/L,c(OH-)<10-7mol/L,溶液呈酸性,结合电荷守恒得:c(NH4+) < c(Cl-),故C错误;
D.根据图像推断,d点溶液中c(H+)=10-7mol/L,常温下c(H+)![]() c(OH-)=Kw=10-14,所以c(H+)= c(OH-),溶液呈中性,如果氨水和盐酸恰好完全反应生成氯化铵,氯化铵为强酸弱碱盐,其溶液显酸性,故D错误。
c(OH-)=Kw=10-14,所以c(H+)= c(OH-),溶液呈中性,如果氨水和盐酸恰好完全反应生成氯化铵,氯化铵为强酸弱碱盐,其溶液显酸性,故D错误。
所以A选项是正确的。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案【题目】某班同学用如下实验探究Fe2+、Fe3+和FeO42-的性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是________;将FeCl3晶体溶于浓盐酸,再稀释到需要的浓度,盐酸的作用是________。
(2)制备K2FeO4(夹持装置略)后,取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
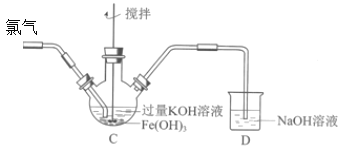
Ⅰ.由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________产生(用方程式表示)。
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是________________。根据K2FeO4的制备原理3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O得出:氧化性Cl2______FeO42-(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是________________。