题目内容
13.下列化学用语的使用正确的是( )| A. | N2的结构式:N≡N | B. | CO2的比例模型: | ||
| C. | 氯化氢的电电子式: | D. | F的原子结构示意图: |
分析 A.用短线“-”代替共用电子对即为结构式;
B.比例模型表示原子的相对大小及原子连接顺序、空间结构;
C.氯化氢是共价化合物;
D.氟原子的核内有9个质子,核外有9个电子;
解答 解:A.N原子之间形成三对共用电子对,结构式只把共用电子对用短线表示,未成键的电子不画出.N2的结构式为N≡N,故A正确;
B.二氧化碳的分子式为CO2,由模型可知小球为碳原子,2个大球为氧原子,氧原子半径大,实际碳原子半径大于氧原子半径,故B错误;
C.氯化氢是共价化合物,所以其电子式为 ,故C错误;
,故C错误;
D.氟原子的核内有9个质子,核外有9个电子,故F原子的结构示意图为 ,故D错误;
,故D错误;
故选A.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及离子结构示意图、电子式、比例模型等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
相关题目
1.下列化学式及结构式中,从成键情况看不合理的是( )
| A. | CH3N, | B. | CH4Si, | C. | CH2SO, | D. | CH4S,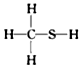 |
8.有机物的结构简式为 ,该分子中共平面的原子最多有( )
,该分子中共平面的原子最多有( )
 ,该分子中共平面的原子最多有( )
,该分子中共平面的原子最多有( )| A. | 20个 | B. | 18个 | C. | 22个 | D. | 24个 |
18.下列有机物发生的反应属于加成反应的是( )
| A. | 乙烯使KMnO4溶液褪色 | B. | 用乙醇、乙酸与浓H2SO4混合加热 | ||
| C. | 乙烯使溴的四氯化碳溶液褪色 | D. | 甲烷和氯水混合,见光 |
2.关于原子轨道的说法正确的是( )
| A. | 凡是中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体 | |
| B. | 1个原子轨道里最多只能容纳2个电子,但自旋方向相同 | |
| C. | sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组新轨道 | |
| D. | 凡AB3型的共价化合物,其中的中心原子A均采用sp3杂化轨道成键 |
20.下列化学用语表示正确的是( )
| A. | HCl的电子式: | B. | Cl的结构示意图: | ||
| C. | 乙烯的结构式CH2=CH2 | D. | 质量数为37的氯原子1737Cl |

 ;
; .
.