题目内容
乙醇的沸点是78℃,能与水以任意比例混溶.乙醚的沸点为34.6℃,难溶于水,在饱和Na2CO3溶液中几乎不溶,乙醚极易燃烧.实验室制乙醚的反应原理是:2CH3CH2OH
CH3CH2OCHCH3+H2O

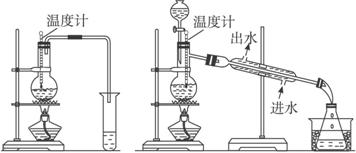
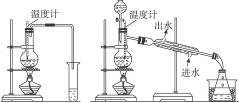
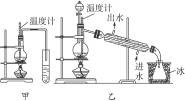
(1)图甲和乙是两套实验室制乙醚的装置,选装置
(2)反应液中应加入沸石,其作用是
(3)反应中温度计水银球的位置是
(4)用装置乙制得的乙醚中可能含有大量的杂质,这杂质是
(5)如果温度太高将会有乙烯生成,该反应的化学方程式是
| H2SO4浓 |
| 140℃ |

(1)图甲和乙是两套实验室制乙醚的装置,选装置
乙
乙
最合适,理由是冷却效果好,乙醚远离火源
冷却效果好,乙醚远离火源
.(2)反应液中应加入沸石,其作用是
防止暴沸
防止暴沸
.(3)反应中温度计水银球的位置是
插入反应物液面以下,但不能触及瓶底
插入反应物液面以下,但不能触及瓶底
.(4)用装置乙制得的乙醚中可能含有大量的杂质,这杂质是
乙醇
乙醇
,除去这种杂质的简易方法是将其与饱和Na2CO3溶液混合,静置分液
将其与饱和Na2CO3溶液混合,静置分液
.(5)如果温度太高将会有乙烯生成,该反应的化学方程式是
CH3CH2OH
CH2=CH2↑+H2O
| 浓硫酸 |
| 170℃ |
CH3CH2OH
CH2=CH2↑+H2O
,反应类型是| 浓硫酸 |
| 170℃ |
消去反应
消去反应
.分析:(1)制取乙醚应有冷凝装置(防止乙醚挥发),收集装置不能离火源太近;
(2)液体加热要加碎瓷片,防止暴沸;
(3)反应中需要控制反应温度在170℃,温度计需要测量混合液的温度;
(4)根据乙醇的沸点(78℃)与反应温度(140℃)相差不大,随着反应温度的提高会有较多的乙醇挥发出来,故应考虑用Na2CO3溶液将乙醚与乙醇分离;
(5)实验室制备乙烯所用的原料为乙醇,浓硫酸作催化剂、脱水剂,反应条件是加热到170℃.
(2)液体加热要加碎瓷片,防止暴沸;
(3)反应中需要控制反应温度在170℃,温度计需要测量混合液的温度;
(4)根据乙醇的沸点(78℃)与反应温度(140℃)相差不大,随着反应温度的提高会有较多的乙醇挥发出来,故应考虑用Na2CO3溶液将乙醚与乙醇分离;
(5)实验室制备乙烯所用的原料为乙醇,浓硫酸作催化剂、脱水剂,反应条件是加热到170℃.
解答:解:(1)通过乙醚的沸点(34.6℃)以及易燃烧可以确定制取乙醚应有冷凝装置(防止乙醚挥发),收集装置不能离火源太近,否则会有危险,
故答案为:乙; 冷却效果好,乙醚远离火源;
(2)因乙醇的沸点低,易暴沸,所以加入沸瓷片作沸石,防暴沸,
故答案为:防止暴沸;
(3)温度计测量的是混合液的温度,所以温度计水银球应该插入反应物液面以下,但不能触及瓶底,
故答案为:插入反应物液面以下,但不能触及瓶底;
(4)由于乙醇的沸点(78℃)与反应温度(140℃)相差不是太大,随着反应温度的提高会有较多的乙醇挥发出来,所以应考虑用Na2CO3溶液将乙醚与乙醇分离,
故答案为:乙醇; 将其与饱和Na2CO3溶液混合,静置分液;
(5)利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,反应方程式为:CH3CH2OH
CH2=CH2↑+H2O,该反应属于消去反应,
故答案为:CH3CH2OH
CH2=CH2↑+H2O;消去反应.
故答案为:乙; 冷却效果好,乙醚远离火源;
(2)因乙醇的沸点低,易暴沸,所以加入沸瓷片作沸石,防暴沸,
故答案为:防止暴沸;
(3)温度计测量的是混合液的温度,所以温度计水银球应该插入反应物液面以下,但不能触及瓶底,
故答案为:插入反应物液面以下,但不能触及瓶底;
(4)由于乙醇的沸点(78℃)与反应温度(140℃)相差不是太大,随着反应温度的提高会有较多的乙醇挥发出来,所以应考虑用Na2CO3溶液将乙醚与乙醇分离,
故答案为:乙醇; 将其与饱和Na2CO3溶液混合,静置分液;
(5)利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,反应方程式为:CH3CH2OH
| 浓硫酸 |
| 170℃ |
故答案为:CH3CH2OH
| 浓硫酸 |
| 170℃ |
点评:本题通过实验室制乙醚方法,主要考查了考查了获取信息的能力与对已学知识的迁移能力,本题难度中等.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目