题目内容
下列叙述错误的是 ( )
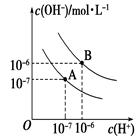
| A.把a L0.1 mol/L的CH3COOH溶液与b L0.1 mol/L的KOH溶液混合,所得溶液中一定存在:c(K+)+c(H+)=c(CH3COO一)+c(OH一) |
| B.把0.1 mol/L的NaHC03溶液与0.3 mol/L的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c(OH一)>c(Ba2+)>c(Na+)>c(H+) |
| C.向1 mol/L的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 |
| D.常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同 |
C
试题分析:A、根据电荷守恒可得:c(K+)+c(H+)=c(CH3COO一)+c(OH一),正确;B、0.1 mol/L的NaHC03溶液与0.3 mol/L的Ba(OH)2溶液等体积混合,发生反应:HCO3?+Ba2++OH?=BaCO3↓+H2O,所得溶液中一定存在:c(OH一)>c(Ba2+)>c(Na+)>c(H+),正确;C、向1 mol/L的CH3COOH溶液中加入少量CH3COONa固体,CH3COO?的浓度增大,CH3COOH的电离平衡向左移动,所以溶液的pH升高,错误;D、常温下, pH=3的CH3COOH溶液,CH3COOH电离出的H+浓度为0.001mol?L?1,pH=11的NaOH溶液,NaOH电离出的OH?为0.001mol?L?1,对水的电离抑制作用相同,正确。

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
 NaOH溶液中逐滴加入。0.2mol
NaOH溶液中逐滴加入。0.2mol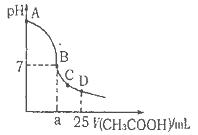
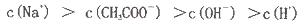
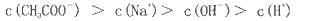
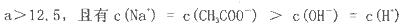
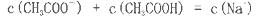
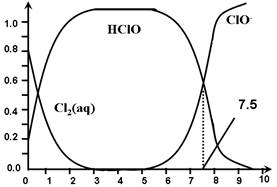
 Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2