题目内容
工业生产硫酸过程中的一步反应是2SO2(g)+O2(g)?2SO3(g).如果该反应在密闭容器内进行,能说明该反应达到化学平衡状态的是( )
| A.SO2完全转化为SO3 |
| B.消耗2molSO2的同时生成2molSO3 |
| C.SO2、O2与SO3的物质的量之比为2:1:2 |
| D.SO2、O2与SO3的浓度不再随时间变化 |
A.可逆反应,反应物不能完全转化,故A错误;
B.消耗2molSO2的同时生成2molSO3,都表示正反应速率,反应始终按此比例进行,故B错误;
C.平衡时各物质的物质的量的多少取决于起始量与转化的程度,不能作为判断达到平衡的依据,故C错误;
D.平衡时各组分的浓度不再发生变化,SO2、O2与SO3的浓度不再随时间变化,说明正逆反应速率相等,反应达到平衡状态,故D正确;
故选D.
B.消耗2molSO2的同时生成2molSO3,都表示正反应速率,反应始终按此比例进行,故B错误;
C.平衡时各物质的物质的量的多少取决于起始量与转化的程度,不能作为判断达到平衡的依据,故C错误;
D.平衡时各组分的浓度不再发生变化,SO2、O2与SO3的浓度不再随时间变化,说明正逆反应速率相等,反应达到平衡状态,故D正确;
故选D.

练习册系列答案
相关题目
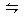 2NH3,并达到平衡,此时N2的转化率为a%,缩小容器的体积,则N2的转化率将( )
2NH3,并达到平衡,此时N2的转化率为a%,缩小容器的体积,则N2的转化率将( )