题目内容
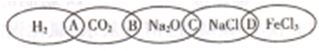
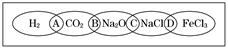
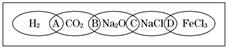
如图为一“铁链”图案,小明在图案上由左到右分别写了H2、CO2、Na2O、NaCl、FeCl3 五种物质,图中相连的两种物质均可归属为一类,相交部分由左到右A、B、C、D为其相应的分类依据代号.

请回答下列问题:
(1)请将分类依据代号填入相应的括号内.
①
③
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入1mol?L-1的上图中一种化合物的水溶液,可制得一种红褐色胶体.
①反应的化学方程式为
②如何用较简单的方法判断胶体是否制备成功?
(3)写出NaCl和FeCl3的电离方程式:
NaCl
(4)电子工业曾用30%的FeCl3溶液腐蚀覆盖铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重新得到FeCl3溶液,设计如下实验流程.

上述流程中,所加试剂的化学式为:X
第⑥步反应的离子方程式为

请回答下列问题:
(1)请将分类依据代号填入相应的括号内.
①
A
A
两种物质都不是电解质 ②C
C
两种物质都是钠的化合物③
B
B
两种物质都是氧化物 ④D
D
两种物质都是盐(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入1mol?L-1的上图中一种化合物的水溶液,可制得一种红褐色胶体.
①反应的化学方程式为
FeCl3+3H2O
Fe(OH)3(胶体)+3HCl
| ||
FeCl3+3H2O
Fe(OH)3(胶体)+3HCl
.
| ||
②如何用较简单的方法判断胶体是否制备成功?
利用丁达尔效应,用一束光照射所得的液体,看是否有一“光亮的通路”出现
利用丁达尔效应,用一束光照射所得的液体,看是否有一“光亮的通路”出现
.(3)写出NaCl和FeCl3的电离方程式:
NaCl
NaCl═Na++Cl-
NaCl═Na++Cl-
; FeCl3FeCl3═Fe3++3Cl-
FeCl3═Fe3++3Cl-
.(4)电子工业曾用30%的FeCl3溶液腐蚀覆盖铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重新得到FeCl3溶液,设计如下实验流程.

上述流程中,所加试剂的化学式为:X
Fe
Fe
,YHCl
HCl
,ZCl2
Cl2
;第⑥步反应的离子方程式为
2Fe2++Cl2═2Fe3++2Cl-
2Fe2++Cl2═2Fe3++2Cl-
.分析:(1)①电解质是在水溶液中或熔融状态下能导电的化合物,常见的电解质包括酸、碱、盐、金属氧化物、水等;
②化合物是由不同种元素组成的纯净物,钠的化合物即化合物中含有钠元素;
③氧化物是指只含有两种元素,且其中一种元素是氧元素的化合物;
④由金属离子(或铵根离子)和酸根离子组成的化合物属于盐;
(2)①制备胶体的原理是利用铁离子水解生成氢氧化铁胶体;
②胶体具有丁达尔性质,是区别其它分散系的独特性质;
(3)强电解质完全电离.用“=”.
(4)使用过的废腐蚀液中含有铜离子和亚铁离子,回收铜并重新得FeCl3溶液的方法依据实验流程进行分析判断.
②化合物是由不同种元素组成的纯净物,钠的化合物即化合物中含有钠元素;
③氧化物是指只含有两种元素,且其中一种元素是氧元素的化合物;
④由金属离子(或铵根离子)和酸根离子组成的化合物属于盐;
(2)①制备胶体的原理是利用铁离子水解生成氢氧化铁胶体;
②胶体具有丁达尔性质,是区别其它分散系的独特性质;
(3)强电解质完全电离.用“=”.
(4)使用过的废腐蚀液中含有铜离子和亚铁离子,回收铜并重新得FeCl3溶液的方法依据实验流程进行分析判断.
解答:解:(1)①常见的电解质包括酸、碱、盐、金属氧化物、水,所以氢气、二氧化碳不是电解质,故选:A;
②氧化钠和氯化钠都是化合物,且都含有钠元素,是钠的化合物,故选:C;
③氧化钠和二氧化碳都是氧化物,故选:B;
④氯化钠和氯化铁都是盐,故选:D;
(2)①反应的化学方程式为:FeCl3+3H2O
Fe(OH)3(胶体)+3HCl,
故答案为:FeCl3+3H2O
Fe(OH)3(胶体)+3HCl.
②利用丁达尔效应,用一束光照射所得的液体,看是否有一“光亮的通路”出现,
故答案为:利用丁达尔效应,用一束光照射所得的液体,看是否有一“光亮的通路”出现;
(3)NaCl和FeCl3的电离方程式分别为:NaCl═Na++Cl-;FeCl3═Fe3++3Cl-,
故答案为:NaCl═Na++Cl-;FeCl3═Fe3++3Cl-.
(4)用30%的FeCl3溶液腐蚀覆盖铜箔的绝缘板制印刷电路板,废腐蚀液中含有铜离子和亚铁离子、三价铁离子,根据分离流程,先加入的x为铁,发生反应有:2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu;过滤或得到亚铁离子的溶液和滤渣铁以及铜;再加入过量盐酸溶解铁后过滤得到铜,得到的氯化亚铁溶液中通入氯气氧化亚铁离子为三价铁离子,重新得到氯化铁溶液;所以推断为:X为:Fe;Y为HCl;Z为Cl2;第⑥步反应的离子方程式为氯气氧化亚铁离子的反应为:2Fe2++Cl2═2Fe3++2Cl-,故答案为:Fe;HCl;Cl2;2Fe2++Cl2═2Fe3++2Cl-.
②氧化钠和氯化钠都是化合物,且都含有钠元素,是钠的化合物,故选:C;
③氧化钠和二氧化碳都是氧化物,故选:B;
④氯化钠和氯化铁都是盐,故选:D;
(2)①反应的化学方程式为:FeCl3+3H2O
| ||
故答案为:FeCl3+3H2O
| ||
②利用丁达尔效应,用一束光照射所得的液体,看是否有一“光亮的通路”出现,
故答案为:利用丁达尔效应,用一束光照射所得的液体,看是否有一“光亮的通路”出现;
(3)NaCl和FeCl3的电离方程式分别为:NaCl═Na++Cl-;FeCl3═Fe3++3Cl-,
故答案为:NaCl═Na++Cl-;FeCl3═Fe3++3Cl-.
(4)用30%的FeCl3溶液腐蚀覆盖铜箔的绝缘板制印刷电路板,废腐蚀液中含有铜离子和亚铁离子、三价铁离子,根据分离流程,先加入的x为铁,发生反应有:2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu;过滤或得到亚铁离子的溶液和滤渣铁以及铜;再加入过量盐酸溶解铁后过滤得到铜,得到的氯化亚铁溶液中通入氯气氧化亚铁离子为三价铁离子,重新得到氯化铁溶液;所以推断为:X为:Fe;Y为HCl;Z为Cl2;第⑥步反应的离子方程式为氯气氧化亚铁离子的反应为:2Fe2++Cl2═2Fe3++2Cl-,故答案为:Fe;HCl;Cl2;2Fe2++Cl2═2Fe3++2Cl-.
点评:本题主要考查了物质的分类和铁的化学性质,难度不大,根据所学知识即可完成.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
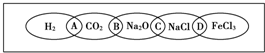 如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号.请回答下列问题:
如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号.请回答下列问题: