题目内容
厦门大学郑兰荪院士合成了C70Cl10富勒烯足球状分子,如下图,它是由C70分子与Cl2发生加成反应得到的.在C70分子中每个碳原子均与周围相邻的其他3个碳原子相连,70个碳原子组成若干个正六边形和正五边形,碳均为4价.则有关说法中不正确的是( )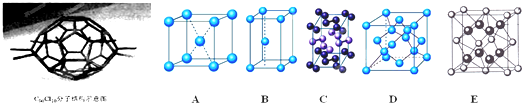

| A、C70的熔点比石墨的熔点低 | B、C70分子中的碳原子的杂化方式与碳酸中的碳原子相同 | C、C70分子中含有70个σ键,35个π键 | D、C70Cl10分子中共用电子对数目为145个 |
分析:A、C70是分子晶体熔点低于混合型晶体石墨;
B、C70分子中每个碳原子均与周围相邻的其他3个碳原子相连,所以碳是sp2杂化,而碳酸中的碳是与三个氧原子形成三σ键和一个π键,故也是sp2杂化;
C、C70分子中一个碳形成
个σ键,和
个π键,所以σ键为70×
=105,π键为70×
=35个;
D、C70→C70Cl10相当5个π键断裂发生加成反应,一个π键断裂多一对共用电子对,所以分子中共用电子对数目为105+35+5=145个.
B、C70分子中每个碳原子均与周围相邻的其他3个碳原子相连,所以碳是sp2杂化,而碳酸中的碳是与三个氧原子形成三σ键和一个π键,故也是sp2杂化;
C、C70分子中一个碳形成
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
D、C70→C70Cl10相当5个π键断裂发生加成反应,一个π键断裂多一对共用电子对,所以分子中共用电子对数目为105+35+5=145个.
解答:解:A、C70是分子晶体熔点低于混合型晶体石墨,故A正确;
B、C70分子中每个碳原子均与周围相邻的其他3个碳原子相连,所以碳是sp2杂化,而碳酸中的碳是与三个氧原子形成三σ键和一个π键,故也是sp2杂化,故B正确;
C、C70分子中一个碳形成
个σ键,和
个π键,所以σ键为70×
=105,π键为70×
=35个,故C错误;
D、C70→C70Cl10相当5个π键断裂发生加成反应,一个π键断裂多一对共用电子对,所以分子中共用电子对数目为105+35+5=145个,故D正确;
故选C.
B、C70分子中每个碳原子均与周围相邻的其他3个碳原子相连,所以碳是sp2杂化,而碳酸中的碳是与三个氧原子形成三σ键和一个π键,故也是sp2杂化,故B正确;
C、C70分子中一个碳形成
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
D、C70→C70Cl10相当5个π键断裂发生加成反应,一个π键断裂多一对共用电子对,所以分子中共用电子对数目为105+35+5=145个,故D正确;
故选C.
点评:本题考查原子杂化类型和晶体熔点的高低,共用电子对的数目,难度较大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
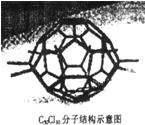 厦门大学郑兰荪院士合成了C50Cl10富勒烯足球状分子,如图,50个碳原子组成若干个正六边形和正五边形,碳均为4价.则有关C50Cl10的说法中不正确的是
厦门大学郑兰荪院士合成了C50Cl10富勒烯足球状分子,如图,50个碳原子组成若干个正六边形和正五边形,碳均为4价.则有关C50Cl10的说法中不正确的是( )
| A、C50Cl10的相对分子质量为955 | B、C50Cl10分子中共用电子对数目为105个 | C、C50Cl10与C60互为同素异形体 | D、C50Cl10分子中含有50个碳碳单键 |


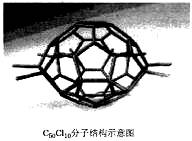 厦门大学郑兰荪院士合成了C50Cl10富勒烯足球状分子,如右图,
厦门大学郑兰荪院士合成了C50Cl10富勒烯足球状分子,如右图,