题目内容
2.在557℃时,密闭容器中进行下列反应CO(g)+H2O(g)?CO2(g)+H2(g).若CO起始浓度为2mol•L-1,水蒸气浓度为3mol•L-1,达到平衡时,测得CO2的浓度为1.2mol•L-1.则该反应中CO的转化率是60%,水蒸气的转化率是40%.分析 利用三段式计算平衡时各组分的平衡浓度,CO起始浓度为2mol•L-1,水蒸气的起始浓度为3mol•L-1,达到平衡后,CO2平衡浓度为1.2mol•L-1,则:
CO(g)+H2O(g)?H2(g)+CO2(g)
开始(mol/L):2 3 0 0
变化(mol/L):1.2 1.2 1.2 1.2
平衡(mol/L):0.8 1.8 1.2 1.2
根据转化率=$\frac{消耗量}{起始量}$×100%计算.
解答 解:CO起始浓度为2mol•L-1,水蒸气的起始浓度为3mol•L-1,达到平衡后,CO2平衡浓度为1.2mol•L-1,则:
CO(g)+H2O(g)?H2(g)+CO2(g)
开始(mol/L):2 3 0 0
变化(mol/L):1.2 1.2 1.2 1.2
平衡(mol/L):0.8 1.8 1.2 1.2
CO的转化率=$\frac{1.2mol/L}{2mol/L}$×100%=60%,
水的转化率=$\frac{1.2mol/L}{3mol/L}$×100%=40%,
故答案为:60%;40%.
点评 本题考查化学平衡的有关计算、平衡转化率计算,比较基础,注意三段式解题法的利用,掌握基础是关键.

练习册系列答案
相关题目
18.下列物质的转化,在给定条件下均能通过一步反应实现的是( )
| A. | N2$→_{放电}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| B. | NaCl(饱和)$→_{②CO_{2}}^{①NH_{3}}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | Fe$→_{点燃}^{少量Cl_{2}}$FeCl2$\stackrel{Cl_{2}}{→}$FeCl3 | |
| D. | FeS2$→_{煅烧}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 |
15.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 中性溶液:Fe3+、K+、Cl-、SO${\;}_{4}^{2-}$ | |
| B. | 1.0mol•L-1的FeCl3溶液:H+、S2-、Cl-、SO${\;}_{4}^{2-}$ | |
| C. | pH=12的溶液:K+、Na+、CH3COO-、Br- | |
| D. | 与铝反应产生氢气的溶液:K+、Na+、CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$ |
2. 常见金属单质A可发生如图所示转化(部分反应物,产物和反应条件已略去).F是一种温室气体;气体G的水溶液显碱性;H是一种具有磁性的黑色氧化物;B,C,D,E四种化合物中含有一种相同的元素.
常见金属单质A可发生如图所示转化(部分反应物,产物和反应条件已略去).F是一种温室气体;气体G的水溶液显碱性;H是一种具有磁性的黑色氧化物;B,C,D,E四种化合物中含有一种相同的元素.
请回答下列问题:
(1)写出F的电子式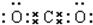 ,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
(2)写出反应Ⅰ的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑,该反应中的氧化剂是H2O.
(3)反应Ⅰ、Ⅱ均有清洁能源H2产生,已知H2的燃烧热为286kJ•mol-1,18g水蒸气变成液态谁放出44kJ的热量.其它相关数据如表:
则表中x为436.
 常见金属单质A可发生如图所示转化(部分反应物,产物和反应条件已略去).F是一种温室气体;气体G的水溶液显碱性;H是一种具有磁性的黑色氧化物;B,C,D,E四种化合物中含有一种相同的元素.
常见金属单质A可发生如图所示转化(部分反应物,产物和反应条件已略去).F是一种温室气体;气体G的水溶液显碱性;H是一种具有磁性的黑色氧化物;B,C,D,E四种化合物中含有一种相同的元素.请回答下列问题:
(1)写出F的电子式
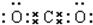 ,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.(2)写出反应Ⅰ的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑,该反应中的氧化剂是H2O.
(3)反应Ⅰ、Ⅱ均有清洁能源H2产生,已知H2的燃烧热为286kJ•mol-1,18g水蒸气变成液态谁放出44kJ的热量.其它相关数据如表:
| 化学键 | O=O(g) | H-H(g) | H-O(g) |
| 键能/kJ•mol-1 | 496 | x | 463 |
14.“页岩气”是从页岩层中开采出来的天然气,是一种重要的非常规天然气资源.我国页岩气储量丰富,这些储量足够中国使用百余年.有关页岩气的叙述错误的是( )
| A. | 页岩气属于一种新能源 | B. | 页岩气属于一种能源 | ||
| C. | 页岩气属于清洁能源 | D. | 页岩气属于不可再生能源 |
11.请按要求完成下列各小题:
(1)用CO2来生产燃料甲醇的反应原理为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
计算上述反应的焓变△H=(2d+3b-c-3a-3e)kJ/mol(用相应字母表示).写出上述反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$;若只加压,则平衡常数K不变(填“增大”“减小”或“不变”).
(2)在溶液中,NaH2PO4和Na3PO4等物质的量混合恰好完全反应,该反应的离子方程式为H2PO4-+PO43-=2HPO42-,
(3)某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=10.在此温度下,将0.01mol•L-1的H2SO4溶液VaL与P
H=12的NaOH溶液VbL混合,若所得混合液pH=11,则Va:Vb=15:2.
(4)在25℃时,将cmol•L-1的醋酸溶液与bmol•L-1NaOH溶液等体积混合后溶液刚好呈中性,用含b、c的代数式表示CH3COOH的电离常数Ka=$\frac{b×1{0}^{-7}}{c-b}$.
(5)三种弱酸HA、H2B、HC,电离平衡常数的数值为:①1.8×10-5、②5.6×10-11、③4.9×10-10、④4.3×10-2(数据顺序以打乱),已知三种酸和它们的盐之间能发生以下反应:HA+HB-(少量)=A-+H2B,H2B(少量)+C-=HB-+HC.则三种酸对应的电离平衡常数分别为(请用序号填空)
(1)用CO2来生产燃料甲醇的反应原理为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
| 化学键 | C-H | H-H | C-O | C=O | H-O |
| 键能/kj•mol-1 | a | b | c | d | e |
(2)在溶液中,NaH2PO4和Na3PO4等物质的量混合恰好完全反应,该反应的离子方程式为H2PO4-+PO43-=2HPO42-,
(3)某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=10.在此温度下,将0.01mol•L-1的H2SO4溶液VaL与P
H=12的NaOH溶液VbL混合,若所得混合液pH=11,则Va:Vb=15:2.
(4)在25℃时,将cmol•L-1的醋酸溶液与bmol•L-1NaOH溶液等体积混合后溶液刚好呈中性,用含b、c的代数式表示CH3COOH的电离常数Ka=$\frac{b×1{0}^{-7}}{c-b}$.
(5)三种弱酸HA、H2B、HC,电离平衡常数的数值为:①1.8×10-5、②5.6×10-11、③4.9×10-10、④4.3×10-2(数据顺序以打乱),已知三种酸和它们的盐之间能发生以下反应:HA+HB-(少量)=A-+H2B,H2B(少量)+C-=HB-+HC.则三种酸对应的电离平衡常数分别为(请用序号填空)
| HA | H2B | HC | ||
| Ka | Ka1 | Ka2 | Ka3 | Ka4 |
| 数值 | ||||