题目内容
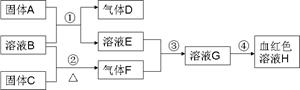
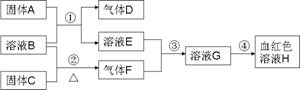
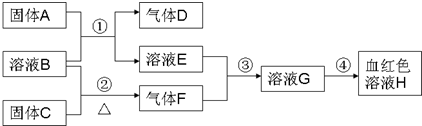
以下为中学常见物质,转化关系如下.C与B溶液反应产生气体F,D可在F中燃烧,图中部分产物略去.
(1)写出固体C化学式
(2)实验室用①制取D、B溶液应为
(3)如何检验E中的阳离子
(4)实验室配制G溶液,操作为
(5)除③可实现E→G外,请用其他物质实现E→G,化学方程式
(6)4gD在空气中完全燃烧生成液体物质时,放出热量为QkJ,写出该反应的热化学方程式

(1)写出固体C化学式
MnO2
MnO2
.(2)实验室用①制取D、B溶液应为
稀
稀
溶液(“浓”或“稀”);若用②制取F,B溶液应为浓
浓
溶液(“浓”或“稀”).写出②反应方程式MnO2+4HCl
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl
MnCl2+Cl2↑+2H2O
.
| ||
(3)如何检验E中的阳离子
取少许溶液E与试管中,滴加KSCN溶液,溶液不变红色,再滴加新制氯水,溶液变为红色,说明含有Fe2+
取少许溶液E与试管中,滴加KSCN溶液,溶液不变红色,再滴加新制氯水,溶液变为红色,说明含有Fe2+
.(4)实验室配制G溶液,操作为
将氯化铁溶解在盐酸中,再稀释到所需要的浓度
将氯化铁溶解在盐酸中,再稀释到所需要的浓度
.(5)除③可实现E→G外,请用其他物质实现E→G,化学方程式
2FeCl2+H2O2+2HCl=2FeCl3+2H2O
2FeCl2+H2O2+2HCl=2FeCl3+2H2O
.(6)4gD在空气中完全燃烧生成液体物质时,放出热量为QkJ,写出该反应的热化学方程式
2H2(g)+O2(g)=2H2O(l);△H=-QkJ/mol
2H2(g)+O2(g)=2H2O(l);△H=-QkJ/mol
.分析:溶液H为血红色,为Fe(SCN)3,由转化关系可知,溶液G含有Fe3+,由反应③可知,溶液E含有Fe元素,由反应①固体A+溶液B→溶液E+气体D,考虑Fe与酸的反应,A为Fe,B为酸,D为H2,E为亚铁盐,由反应③可知气体F具有强氧化性,结合反应②溶液B+固体C
气体F,考虑F为Cl2,B为盐酸,C为MnO2,故E为FeCl2,G为FeCl3,氢气可以在氯气中燃烧,氯气能将FeCl2氧化为FeCl3,验证符合转化关系.
| △ |
解答:解:溶液H为血红色,为Fe(SCN)3,由转化关系可知,溶液G含有Fe3+,由反应③可知,溶液E含有Fe元素,由反应①固体A+溶液B→溶液E+气体D,考虑Fe与酸的反应,A为Fe,B为酸,D为H2,E为亚铁盐,由反应③可知气体F具有强氧化性,结合反应②溶液B+固体C
气体F,考虑F为Cl2,B为盐酸,C为MnO2,故E为FeCl2,G为FeCl3,氢气可以在氯气中燃烧,氯气能将FeCl2氧化为FeCl3,验证符合转化关系,则:
(1)由上述分析可知,C为MnO2,故答案为:MnO2;
(2)实验室用①制取氢气,利用铁与稀盐酸反应生成氯化亚铁与氢气;若用②制取氯气,为二氧化锰与浓盐酸在加热的条件下生成氯化锰、氯气与水,反应方程式为:MnO2+4HCl
MnCl2+Cl2↑+2H2O,
故答案为:稀;浓;MnO2+4HCl
MnCl2+Cl2↑+2H2O;
(3)E为FeCl2溶液,检验Fe2+方法:取少许溶液E与试管中,滴加KSCN溶液,溶液不变红色,再滴加新制氯水,溶液变为红色,说明含有Fe2+,
故答案为:取少许溶液E与试管中,滴加KSCN溶液,溶液不变红色,再滴加新制氯水,溶液变为红色,说明含有Fe2+;
(4)Fe3+易水解,实验室配制FeCl3溶液,加入盐酸防止水解,配制氯化铁溶液,可先将氯化铁溶解在盐酸中,再稀释到所需要的浓度,
故答案为:将氯化铁溶解在盐酸中,再稀释到所需要的浓度;
(5)除利用氯气将FeCl2氧化为FeCl3,还可以利用H2O2等强氧化性物质,反应方程式为:2FeCl2+H2O2+2HCl=2FeCl3+2H2O,
故答案为:2FeCl2+H2O2+2HCl=2FeCl3+2H2O;
(6)4g氢气的物质的量为
=2mol,在空气中完全燃烧生成液体水时,放出热量为QkJ,该反应的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=-QkJ/mol,
故答案为:2H2(g)+O2(g)=2H2O(l)△H=-QkJ/mol.
| △ |
(1)由上述分析可知,C为MnO2,故答案为:MnO2;
(2)实验室用①制取氢气,利用铁与稀盐酸反应生成氯化亚铁与氢气;若用②制取氯气,为二氧化锰与浓盐酸在加热的条件下生成氯化锰、氯气与水,反应方程式为:MnO2+4HCl
| ||
故答案为:稀;浓;MnO2+4HCl
| ||
(3)E为FeCl2溶液,检验Fe2+方法:取少许溶液E与试管中,滴加KSCN溶液,溶液不变红色,再滴加新制氯水,溶液变为红色,说明含有Fe2+,
故答案为:取少许溶液E与试管中,滴加KSCN溶液,溶液不变红色,再滴加新制氯水,溶液变为红色,说明含有Fe2+;
(4)Fe3+易水解,实验室配制FeCl3溶液,加入盐酸防止水解,配制氯化铁溶液,可先将氯化铁溶解在盐酸中,再稀释到所需要的浓度,
故答案为:将氯化铁溶解在盐酸中,再稀释到所需要的浓度;
(5)除利用氯气将FeCl2氧化为FeCl3,还可以利用H2O2等强氧化性物质,反应方程式为:2FeCl2+H2O2+2HCl=2FeCl3+2H2O,
故答案为:2FeCl2+H2O2+2HCl=2FeCl3+2H2O;
(6)4g氢气的物质的量为
| 4g |
| 2g/mol |
故答案为:2H2(g)+O2(g)=2H2O(l)△H=-QkJ/mol.
点评:本题以无机框图题的形式考查Fe、Cl等元素单质及其化合物之间的相互转化关系和逻辑推理能力、热化学方程式等化学用语的书写、离子检验、盐类水解应用等,本题中溶液H为血红色,为解题突破口,根据Fe元素单质及化合物性质进行猜测,然后再进行验证,对学生的基础知识熟练程度与逻辑推理能力提出较高要求,难度较大.

练习册系列答案
相关题目