题目内容
12.今有下列几种导电性变化图象.把符合要求的序号填在相应的题目后面括号中
(1)向H2SO4溶液中加入等体积、等物质的量浓度的Ba(OH)2溶液④
(2)向H2SO4溶液中通入Cl2直至过量②
(3)向AgNO3溶液通入少量HCl③
(4)向氨水中通入HCl直至过量②
(5)向NaOH溶液中通入少量Cl2③
(6)向饱和石灰水中不断通入CO2①.
分析 溶液导电性和溶液中离子浓度大小有关,相同条件下,离子浓度越大,导电性越强,离子所带电荷有关,离子所带电荷数越高导电性越强,单位体积的溶液中离子数越多导电性越强,
(1)向H2SO4溶液中加入等体积、等物质的量浓度的Ba(OH)2溶液发生反应生成硫酸钡和水,溶液导电性减小;
(2)向H2SO4溶液中通入Cl2直至过量溶液中离子浓度增大;
(3)向AgNO3溶液通入少量HCl,发生反应生成氯化银沉淀和硝酸,溶液中离子浓度基本不变;
(4)向氨水中通入HCl直至过量,溶液中离子浓度增大;
(5)氢氧化钠溶液中通入氯气发生反应生成氯化钠、次氯酸钠和水,溶液中离子浓度变化不大;
(6)向饱和石灰水中不断通入CO2 发生反应生成碳酸钙沉淀,离子浓度减小,随不断通入碳酸钙溶解,溶液中离子浓度增大;
解答 解:(1)向H2SO4溶液中加入等体积、等物质的量浓度的Ba(OH)2溶液发生反应生成硫酸钡和水,离子浓度减小导电性减弱,完全中和导电性接近于0,故选④,
故答案为:④;
(2)向H2SO4溶液中通入Cl2直至过量,氯气和水反应生成盐酸和次氯酸,离子数增大,溶液导电性增强,当溶液饱和时趋于最大后导电性不变,故选②,
故答案为:②;
(3)向AgNO3溶液通入少量HCl,发生反应生成氯化银沉淀和硝酸,减少的银离子由氢离子补充,溶液中离子浓度基本不变,导电性基本不变,故选③,
故答案为:③;
(4)向氨水中通入HCl直至过量,氯化氢和一水合氨反应生成氯化铵溶液,溶液中离子浓度增大,导电性增强,饱和后离子浓度基本不变,导电性不变,故选②,
故答案为:②;
(5)氢氧化钠溶液中通入氯气发生反应生成氯化钠、次氯酸钠和水,氯化钠和次氯酸钠是强电解质完全电离,溶液中离子浓度变化不大,溶液导电性变化不大,故选③,
故答案为:③;
(6)向饱和石灰水中不断通入CO2 发生反应生成碳酸钙沉淀,离子浓度减小,随不断通入碳酸钙溶解,溶液中离子浓度增大,导电性显减小后增大,故选①,
故答案为:①.
点评 本题考查了溶液导电性的分析判断,主要是物质性质和反应前后离子浓度的变化,掌握基础是解题关键,题目难度中等.

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案| A. | 原子半径:C<N<S | B. | 第一电离能:Na<Mg<Al | ||
| C. | 电负性:P<N<O | D. | 气态氢化物的稳定性:NH3<H2O<H2S |
 下列关于该有机物的叙述中,不正确的是( )
下列关于该有机物的叙述中,不正确的是( )| A. | 能与金属钠发生反应并放出氢气 | |
| B. | 能在催化剂作用下与H2发生加成反应 | |
| C. | 能使酸性KMnO4溶液褪色 | |
| D. | 在铜作催化剂条件下不能能发生催化氧化反应 |
| A. | HCl | B. | NaCl | C. | CO2 | D. | 干燥的氯气 |
| A. | 二氧化硅中有少量的氧化铝:加过量的烧碱溶液后过滤 | |
| B. | 乙醇中有水:分液 | |
| C. | Na2CO3溶液(Na2SO4):加入适量Ba(OH)2溶液,过滤 | |
| D. | CO2气体(HCl):通过饱和NaHCO3溶液后干燥 |
| 选项 | 实验操作 | 实验象 | 结论 |
| A | 将AlCl3溶液逐滴加NaOH溶液中 | 先无现象后产生白色胶状沉淀 | Al(OH)3是两性氢氧化物 |
| B | 向2支盛有醋酸和硼酸溶液的管中分别滴加Na2CO3溶液 | 醋酸:产生气泡; 硼酸:无现象 | Ka(CH3COOH)>Ka1(H2CO3)>Ka(H3BO3) |
| C | 将少量MgCl2溶液加入Fe(OH)3悬浊液中,振荡静置 | 沉淀由红褐色变为白色 | Fe(OH)3的溶解度大于Mg(OH)2 |
| D | 溴乙烷、乙醇及固体NaOH混合加热,产生的气态物质通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | 溴乙烷发生消去反应生成了乙烯 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 平衡向正反应方向移动了 | B. | 物质B的质量分数减小了 | ||
| C. | 物质A的转化率减少了 | D. | a>b |
| A. | 乙醇的分子式 C2H5OH | B. | 苯分子的实验式为CH | ||
| C. | 次氯酸的电子式 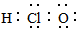 | D. | 乙烯的结构简式 CH2CH2 |
