��Ŀ����
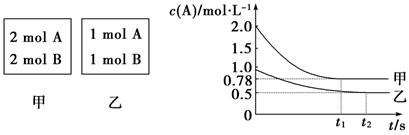
(8��)����������ݻ���Ϊ1 L�ĺ��������У��ֱ����2 mol A��2 mol B��1 mol A��1 mol B����ͬ������(�¶�T ��)���������з�Ӧ��A(g)��B(g) xC(g)����H<0�������������c(A)��ʱ��t�ı仯��ͼ��ʾ��
xC(g)����H<0�������������c(A)��ʱ��t�ı仯��ͼ��ʾ��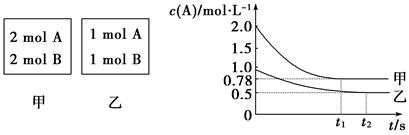
�ش��������⣺
(1)�������У�ƽ�������B��ת����________��
(2)x��________��
(3)T ��ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ________��
(4)����˵����ȷ����________��
A����ƽ�����������г��뺤����ʹc(A)����
B�����������������¿�ʹ�������ڸ����ʵ����������������ڵ���ͬ
C��������������ٳ���2 mol A��2 mol B����ƽ��ʱ��������0.78 mol��L��1<c(A)<1.56 mol��1
��8�֣� (1)50%����2�֣�(2) 1��2�֣���(3) 2��2�֣���(4)C��2�֣�
����

��ϰ��ϵ�д�
�����Ŀ
 xC(g)����H<0�������������c(A)��ʱ��t�ı仯��ͼ��ʾ��
xC(g)����H<0�������������c(A)��ʱ��t�ı仯��ͼ��ʾ��