题目内容
(2013?安徽模拟)亚硝酸盐是一祌常见的食品添加剂,使用时必须严格控制其用量.为检测某食品中亚硝 酸盐含量(通常以1kg样品中含NaN02的质量计),某研究小组设计了如下两种实验方案: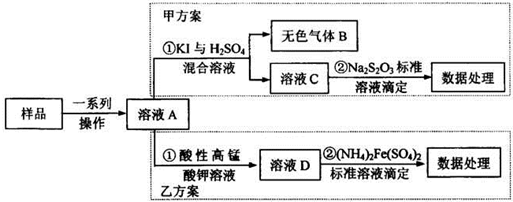
(1)无色气体B遇空气显红棕色,B的化学式为
(2)完成并配平乙方案①中反应的离子方程式
(3)乙方案②中需配置100mL0.0010mol/L(NH4)2Fe(SO4)2标准溶液,在已准确称量样品的质量后,还需要的仪器有:量筒、烧杯、
(4)若取样品ag,按乙方案进行测定,准确量取12.00mL0.0005mol/L的酸性高锰酸钾 溶液(过童)与溶液A反应.反应后溶液用0.0010mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色 溶液刚好褪去;重复上述实验2次,平均消耗(NH4)2Fe(SO4)2溶液1O.OOmL.则1kg样品中 NaNO2的质量为
mg.

(1)无色气体B遇空气显红棕色,B的化学式为
NO
NO
写出甲方案①中反应的离子方程式2I-+2NO2-+4H+=I2+2NO↑+2H2O
2I-+2NO2-+4H+=I2+2NO↑+2H2O
(2)完成并配平乙方案①中反应的离子方程式
2
2
MnO4-+5
5
NO2+6
6
=2
2
Mn 2++5
5
NO3-+3
3
(3)乙方案②中需配置100mL0.0010mol/L(NH4)2Fe(SO4)2标准溶液,在已准确称量样品的质量后,还需要的仪器有:量筒、烧杯、
玻璃棒、100mL容量瓶、胶头滴管
玻璃棒、100mL容量瓶、胶头滴管
配制溶液时,定容的操作方法是向容量瓶中注入蒸馏水,当液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至液面与刻度线相切.
向容量瓶中注入蒸馏水,当液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至液面与刻度线相切.
(4)若取样品ag,按乙方案进行测定,准确量取12.00mL0.0005mol/L的酸性高锰酸钾 溶液(过童)与溶液A反应.反应后溶液用0.0010mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色 溶液刚好褪去;重复上述实验2次,平均消耗(NH4)2Fe(SO4)2溶液1O.OOmL.则1kg样品中 NaNO2的质量为
| 690 |
| a |
| 690 |
| a |
分析:(1)无色气体B遇空气显红棕色,说明是一氧化氮被氧气氧化为二氧化氮红棕色气体;甲方案①中反应是亚硝酸盐在酸性溶液中氧化碘离子为碘单质,本身被还原为一氧化氮;
(2)依据氧化还原反应电子守恒,结合元素化合价变化升降守恒配平书写离子方程式;
(3)依据配制溶液的操作步骤选择需要的仪器;定容方法是容量瓶中加入水至离刻度线1-2cm,改用胶头滴管滴加制液面与刻度线相切;
(4)利用高锰酸钾氧化亚硝酸根离子为硝酸根离子,过量的高锰酸钾被硫酸亚铁铵还原恰好反应,结合离子方程式的定量关系计算得到;
(2)依据氧化还原反应电子守恒,结合元素化合价变化升降守恒配平书写离子方程式;
(3)依据配制溶液的操作步骤选择需要的仪器;定容方法是容量瓶中加入水至离刻度线1-2cm,改用胶头滴管滴加制液面与刻度线相切;
(4)利用高锰酸钾氧化亚硝酸根离子为硝酸根离子,过量的高锰酸钾被硫酸亚铁铵还原恰好反应,结合离子方程式的定量关系计算得到;
解答:解:(1)依据流程分析判断,无色气体B遇空气显红棕色,说明是一氧化氮被氧气氧化为二氧化氮红棕色气体;甲方案①中反应是亚硝酸盐在酸性溶液中氧化碘离子为碘单质,本身被还原为一氧化氮,反应的离子方程式为:2I-+2NO2-+4H+=I2+2NO↑+2H2O;
故答案为:NO,2I-+2NO2-+4H+=I2+2NO↑+2H2O;
(2)依据氧化还原反应元素化合价变化,锰元素化合价从+7价变化为+2价锰离子,氮元素化合价从+3价变化为+5价,依据化合价变化升降相同和原子守恒配平写出离子方程式为:2MnO4-+5NO2-+6H+=2 Mn2++5NO3-+3H2O;
故答案为:2、5、6、2、5、3;
(3)配制溶液需要称量后在烧杯中溶解,用玻璃棒搅拌,引流转移到100ml容量瓶中加水至离刻度线1-2cm处改用胶头滴管滴加至液面到与刻度线相切;
故答案为:玻璃棒、100mL容量瓶、胶头滴管,向容量瓶中注入蒸馏水,当液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至液面与刻度线相切;
(4)依据反应过程和离子方程式加水得到
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,
1 5
2×10-6mol 0.0010mol/L×0.01L
与亚硝酸根离子反应的高锰酸钾物质的量=0.012.00L×0.0005mol/L-2×10-6mol=4×10-6mol;
2MnO4-+5NO2-+6H+=2 Mn2++5NO3-+3H2O;
2 5
4×10-6mol 10-5mol
ag样品含 NaNO2的质量为69g/mol×10-5mol=6.9×10-4g;
1000g样品中含NaNO2的质量=
=
mg;
故答案为:
mg;
故答案为:NO,2I-+2NO2-+4H+=I2+2NO↑+2H2O;
(2)依据氧化还原反应元素化合价变化,锰元素化合价从+7价变化为+2价锰离子,氮元素化合价从+3价变化为+5价,依据化合价变化升降相同和原子守恒配平写出离子方程式为:2MnO4-+5NO2-+6H+=2 Mn2++5NO3-+3H2O;
故答案为:2、5、6、2、5、3;
(3)配制溶液需要称量后在烧杯中溶解,用玻璃棒搅拌,引流转移到100ml容量瓶中加水至离刻度线1-2cm处改用胶头滴管滴加至液面到与刻度线相切;
故答案为:玻璃棒、100mL容量瓶、胶头滴管,向容量瓶中注入蒸馏水,当液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至液面与刻度线相切;
(4)依据反应过程和离子方程式加水得到
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,
1 5
2×10-6mol 0.0010mol/L×0.01L
与亚硝酸根离子反应的高锰酸钾物质的量=0.012.00L×0.0005mol/L-2×10-6mol=4×10-6mol;
2MnO4-+5NO2-+6H+=2 Mn2++5NO3-+3H2O;
2 5
4×10-6mol 10-5mol
ag样品含 NaNO2的质量为69g/mol×10-5mol=6.9×10-4g;
1000g样品中含NaNO2的质量=
| 6.9×10-4mol×1000g |
| ag |
| 690 |
| a |
故答案为:
| 690 |
| a |
点评:本题考查了反应流程的分析判断,氧化还原反应的离子方程式书写和配平,物质性质的分析应用,滴定实验过程分析计算应用是解题关键,题目难度中等.

练习册系列答案
相关题目
 (2013?安徽模拟)由碳原子构成的纳米碳管可以作为储存氢气的优良容器,其单层部分结构示意图如图,下列说法正确的是( )
(2013?安徽模拟)由碳原子构成的纳米碳管可以作为储存氢气的优良容器,其单层部分结构示意图如图,下列说法正确的是( )