题目内容
3.下列有机物分子中,所有碳原子不可能处于同一平面的是( )| A. |  | B. | CH3-C≡C-CH3 | C. |  | D. |  |
分析 在常见的有机化合物中甲烷是正四面体结构,乙烯和苯是平面型结构,乙炔是直线型结构,其它有机物可在此基础上进行判断.
解答 解:A.苯为平面结构,甲苯中甲基碳原子处于苯中H原子位置,所有碳原子都处在同一平面上,故A正确;
B.乙炔是直线型结构,四个碳原子在同一直线上,故B正确;
C.乙烯为平面结构,甲基上的碳原子处于乙烯中H原子位置,所有碳原子可能处在同一平面上,故C正确;
D.甲烷是正四面体结构,3个甲基上的碳原子四面体的顶点位置,中间碳原子处于该四面体内部,所以碳原子不可能处于同一平面,故D错误.
故选D.
点评 本题主要考查有机化合物的结构特点,做题时注意从甲烷、乙烯、苯结构特点判断有机分子的空间结构,难度不大.

练习册系列答案
相关题目
11.以下化学用语正确的是( )
| A. | 苯的实验式 C6H6 | B. | 乙醇的分子式CH3CH2OH | ||
| C. | 乙烯的结构简式CH2CH2 | D. | 甲醛的结构式: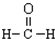 |
18.下列有关说法中正确的是( )
| A. | 第一电离能越大的原子越容易得到电子 | |
| B. | 同周期元素从左到右第一电离能一定增大 | |
| C. | 同周期元素电负性从左到右越来越大 | |
| D. | 金属元素的电负性一定小于非金属元素 |
8.在密闭容器中发生反应X(g)+3Y(g)?2Z(g),若X、Y、Z的起始浓度分别为0.2mol•L-1、0.3mol•L-1和0.2mol•L-1,则平衡时各物质的浓度不可能是( )
| A. | X为0.25 mol•L-1 | |
| B. | Y为0.1 mol•L-1 | |
| C. | Z为0.2 mol•L-1 | |
| D. | Z为0.25 mol•L-1时,Y为0.45 mol•L-1 |
15.元素的性质随着原子序数的递增呈周期性变化的原因是( )
| A. | 元素的化合价的周期性变化 | |
| B. | 元素原子的原子半径的周期性变化 | |
| C. | 元素原子的核外电子排布的周期性变化 | |
| D. | 元素原子的电子层数的周期性变化 |
13.在下列分子结构中,有原子的最外层电子不能满足8电子稳定结构的是( )
| A. | N2 | B. | PCl3 | C. | PCl5 | D. | CO2 |

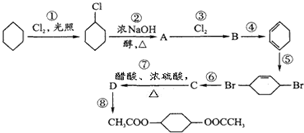 从环己烷可制备1,4-环己二醇二醋酸酯,下列过程是有关的8步反应(其中所有无机产物都已略去):
从环己烷可制备1,4-环己二醇二醋酸酯,下列过程是有关的8步反应(其中所有无机产物都已略去): ,C
,C ,D
,D .
. ;
; ;
; .
.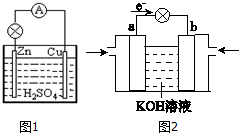 原电池是直接把化学能转化为电能的装置.
原电池是直接把化学能转化为电能的装置.