题目内容
18.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.如表是元素周期表的一部分.| H | He | ||||||
| Li | Be | B | C | N | O | F | Ne |
| Na | Mg | Al | Si | P | S | Cl | Ar |
(1)非金属性最强的元素名称为氟,它位于元素周期表中的位置是第二周期ⅦA族.
(2)硅元素的原子结构示意图是
 ,其最高价氧化物是酸性(填“酸性”或“碱性”)氧化物.
,其最高价氧化物是酸性(填“酸性”或“碱性”)氧化物.(3)硼酸(H3BO3)的酸性<(填“>”或“<”)碳酸(H2CO3)的酸性,说明你判断的理由:B和C 位于同一周期,原子序数B<C,原子半径B>C,得电子能力B<C,故非金属性B<C,最高氧化物对应的水化物酸性H3BO3<H2CO3.
(4)NH3的电子式为
 ,它属于共价(填“离子”或“共价”)化合物.NH3的还原性<(填“>”或“<”)PH3的还原性.
,它属于共价(填“离子”或“共价”)化合物.NH3的还原性<(填“>”或“<”)PH3的还原性.(5)第三周期元素的最高价氧化物对应的水化物中,有一种物质既能与强酸反应又能与强碱反应,写出这种物质跟氢氧化钠溶液反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O.
分析 (1)同周期自左而右元素非金属性增强、同主族自上而下元素非金属性减弱;
(2)Si原子核外有14个电子,有3个电子层,各层电子数分别为2、8、4;二氧化硅水酸性氧化物;
(3)元素非金属性越强,其最高价氧化物对应水化物的酸性越强;
(4)NH3分子中N原子与H原子之间形成1对共用电子对;元素非金属性越强,氢化物还原性越弱;
(5)第三周期元素的最高价氧化物对应的水化物中,既能与强酸反应又能与强碱反应为氢氧化铝,与氢氧化钠反应生成偏铝酸钠与水.
解答 解:(1)同周期自左而右元素非金属性增强、同主族自上而下元素非金属性减弱,故F元素非金属性最强,处于周期表中第二周期ⅦA族,故答案为:氟;第二周期ⅦA族;
(2)Si原子核外有14个电子,有3个电子层,各层电子数分别为2、8、4,原子结构示意图为 ,二氧化硅能与氢氧化钠反应生成硅酸钠与水,故其属于酸性氧化物,故答案为:
,二氧化硅能与氢氧化钠反应生成硅酸钠与水,故其属于酸性氧化物,故答案为: ;酸性;
;酸性;
(3)B和C 位于同一周期,原子序数B<C,原子半径B>C,得电子能力B<C,故非金属性B<C,最高氧化物对应的水化物酸性H3BO3<H2CO3,
故答案为:<;B和C 位于同一周期,原子序数B<C,原子半径B>C,得电子能力B<C,故非金属性B<C,最高氧化物对应的水化物酸性H3BO3<H2CO3;
(4)NH3分子中N原子与H原子之间形成1对共用电子对,电子式为 ,属于共价化合物;由于元素非金属性N>P,氢化物还原性:NH3<PH3,
,属于共价化合物;由于元素非金属性N>P,氢化物还原性:NH3<PH3,
故答案为: ;共价;<;
;共价;<;
(5)第三周期元素的最高价氧化物对应的水化物中,既能与强酸反应又能与强碱反应为氢氧化铝,与氢氧化钠反应生成偏铝酸钠与水,反应方程式为:Al(OH)3+NaOH=NaAlO2+2H2O,
故答案为:Al(OH)3+NaOH=NaAlO2+2H2O.
点评 本题考查元素周期表与元素周期律,侧重大于化学用语与元素周期律的考查,有利于基础知识的巩固.

| A. | 电解时,石墨作阴极,不锈钢作阳极 | |
| B. | 电解时,阳极反应是:I--6e-+3H2O═IO3-+6H+ | |
| C. | 溶液调节至强酸性,对生产不利 | |
| D. | 电解后阴极周围溶液的pH升高 |
| 编号 | 实验 | 操作 |
| A | 测定次氯酸钠的pH | 用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,变色后,与标准比色卡对比 |
| B | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000mL的容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 排除碱式滴定管尖嘴部分的气泡 | 将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴快速流出 |
| D | 取出分液漏斗中所需的上层液体 | 将下层液体从分液漏斗下端管口放出后,关闭活塞,换一个接收容器,从分液漏斗下端管口继续放出下层液体 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 氮原子结构示意图: | B. | 乙烯的结构式:CH2CH2 | ||
| C. | 含有10个中子的氧原子:${\;}_{10}^{18}$O | D. | 苯的结构简式: |
| A. | s轨道呈圆形,p轨道呈哑铃形 | |
| B. | Cu元素在元素周期表的ds区 | |
| C. | 1.5g CH3+中含有的电子数为0.8NA | |
| D. | DNA中的碱基互补配对是通过氢键来实现的 |
| A. | 甲升高温度,乙不变 | B. | 甲中加入0.1molHe,乙不变 | ||
| C. | 甲、乙提高相同温度 | D. | 甲增加0.1molH2,乙不变 |
| A. | 在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| B. | c (H+)=0.lmol•L-1的溶液中:Cu2+、A13+、SO42-、NO3- | |
| C. | 能使红色石蕊试纸变蓝的溶液中:K+、CO32-、NO3-、AlO2- | |
| D. | 在含有大量 Fe3+的溶液中:NH4+、Na+、Cl-、SO42- |
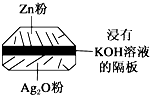 (1)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2$S{O}_{4}^{2-}$$?_{充电}^{放电}$2PbSO4+2H2O.请回答下列问题(不考虑氢、氧的氧化还原):
(1)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2$S{O}_{4}^{2-}$$?_{充电}^{放电}$2PbSO4+2H2O.请回答下列问题(不考虑氢、氧的氧化还原): 在100mlNaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热使之充分反应,下图表示加入固体的质量与产生气体的体积(标准状况)的关系,试回答:
在100mlNaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热使之充分反应,下图表示加入固体的质量与产生气体的体积(标准状况)的关系,试回答: