题目内容
【题目】磷化铝(AlP)通常可作为一种广谱性熏蒸杀虫剂,吸水后会立即产生高毒性PH3气体(沸点-89.7℃,还原性强)。某化学兴趣小组的同学用下述方法测定粮食中残留磷化物的含量。

在C中加入l00g原粮,E中加入20.00mL l.50×l0-3 mol·L-1 KMnO4溶液(H2SO4酸化),往C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中过量的KMnO4溶液。
回答下列问题:
(1)仪器D的名称是____________________________________。
(2)AlP与水反应的化学方程式为______________________________________________。
(3)装置A中盛装KMnO4溶液的作用是除去空气中的还原性气体,装置B中盛有焦性没食子酸的碱性溶液,其作用是__________________。
(4)通入空气的作用是_____________________________。
(5)装置E中PH3被氧化成磷酸,则装置E中发生反应的氧化剂和还原剂物质的量之比为___________________________。
(6)收集装置E中的吸收液,加水稀释至250mL,取25.00mL于锥形瓶中,用4.0×l0-4 mol·L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液15.00mL,Na2SO3与KMnO4溶液反应的离子方程式为:________________________________,则该原粮中磷化物(以PH3计)的含量为________________mg·kg-1(写计算表达式和计算结果)。
【答案】 直形冷凝管(或冷凝管) AlP+3H2O= PH3↑+Al(OH)3 吸收空气中的O2 保证生成的PH3全部被酸性KMnO4溶液吸收 8:5 5SO32-+2MnO4-+6H+=5SO42-+2Mn2++3H2O ![]() = 1.275
= 1.275
【解析】(1)该装置为直形冷凝管或冷凝管;
(2)根据题目描述,AlP吸水产生高毒性的PH3↑,所以反应的化学方程式为AlP+3H2O= PH3↑+Al(OH)3;
(3)因为PH3具有很强的还原性,所以要除去空气中的氧气,故装置B中盛有的焦性没食子酸的碱性溶液的作用就是吸收空气中的O2,防止PH3被氧化;
(4)通入空气的作用是将装置内生成的PH3气体全部排出,进入装置E中,减小实验误差;(5)在装置E中,PH3作还原剂,被氧化成磷酸,P元素的化合价升高8,MnO4-作氧化剂,被还原为Mn2+,Mn元素的化合价降低5,根据电子转移守恒可得,反应的化学方程式为:5PH3+8KMnO4+12H2SO4=5H3PO4+4K2SO4+8MnSO4+12H2O,其中氧化剂和还原剂物质的量之比为8∶5;
(6) Na2SO3与酸性KMnO4溶液反应的离子方程式为5SO32-+2MnO4-+6H+=5SO42-+2Mn2++
3H2O,已知KMnO4的总物质的量为n(KMnO4)= 20×10-3L×l.50×l0-3 mol·L-1=3×l0-5 mol,
则与Na2SO3反应的KMnO4的物质的量为n(KMnO4)= ![]() ×n(Na2SO3) =
×n(Na2SO3) = ![]() ×(15×10-3L×4.0×10-4 mol·L-1)×
×(15×10-3L×4.0×10-4 mol·L-1)×![]() =2.4×10-5 mol,所以与PH3反应的n(KMnO4)= 3×l0-5 mol-2.4×10-5 mol=0.6×10-5 mol,又PH3与KMnO4酸性溶液反应的化学方程式为5PH3+8KMnO4+12H2SO4=5H3PO4+4K2SO4+8MnSO4+12H2O,所以原粮中磷化物(以PH3计)的含量为:= (
=2.4×10-5 mol,所以与PH3反应的n(KMnO4)= 3×l0-5 mol-2.4×10-5 mol=0.6×10-5 mol,又PH3与KMnO4酸性溶液反应的化学方程式为5PH3+8KMnO4+12H2SO4=5H3PO4+4K2SO4+8MnSO4+12H2O,所以原粮中磷化物(以PH3计)的含量为:= (![]() ×0.6×10-5 mol×34g/mol×103mg/g-1)/(100×10-3kg)=1.275 mg/ kg
×0.6×10-5 mol×34g/mol×103mg/g-1)/(100×10-3kg)=1.275 mg/ kg

【题目】下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是()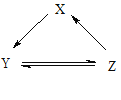
项目 | X | Y | Z |
A | Si | SiO2 | H2SiO3 |
B | Na | NaOH | NaCl |
C | NO | NO2 | HNO3 |
D | NaClO | HClO | Cl2 |
A. A B. B C. C D. D


