题目内容
【题目】(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3。[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
①基态Fe3+的M层电子排布式是________________。
②尿素(H2NCONH2)分子中C、N原子的杂化方式分别是__________、__________。
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x =_______。
(2)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3的VSEPR模型名称为_____;在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在左下图中表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键_____。

【答案】 3s23p63d5 sp2 sp3 5 四面体 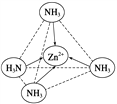
【解析】(1)①Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+电子排布式为1s22s22p63s23p63d5,基态Fe3+的M层电子排布式为3s23p63d5 ; ②由尿素分子的结构式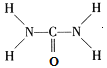 可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化;③ 配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,8+2x=18,x=5;(2)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。根据价层电子对互斥理论,配位体NH3价层电子对个数=3+
可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化;③ 配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,8+2x=18,x=5;(2)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。根据价层电子对互斥理论,配位体NH3价层电子对个数=3+![]() (5-3×1)=4,所以其VSEPR模型名称为正四面体;在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,表示[Zn(NH3)4]2+中Zn2+与N之间的化学键如图:
(5-3×1)=4,所以其VSEPR模型名称为正四面体;在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,表示[Zn(NH3)4]2+中Zn2+与N之间的化学键如图: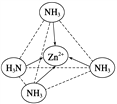 。
。
