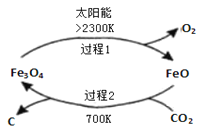
题目内容
【题目】甲醇(结构式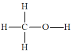 )是一种基础有机化工原料,应用广泛。工业上可利用废气中的CO2合成CH3OH,发生反应CO2(g)+3H2(g)
)是一种基础有机化工原料,应用广泛。工业上可利用废气中的CO2合成CH3OH,发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49 kJ·mol-1。
CH3OH(g)+H2O(g) △H=-49 kJ·mol-1。
(1)已知反应中的相关化学键键能数据如下:
化学键 | O-H | C-O | C=O |
E/(kJ | 465 | 343 | 750 |
甲醇中C-H键比氢气中H-H键____(填“强”或“弱”)。相同条件下该反应的正反应活化能Ea(正)=210 kJ·mol-1,则逆反应活化能Ea(逆)=______kJ·mol-1。
(2)在1 L恒容密闭容器中充入CO2和H2,所得实验数据如下表
实验编号 | 温度/。C | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(CO2) | n(H2) | n(CH3OH) | ||
① | 150 | 0.23 | 0.19 | 0.03 |
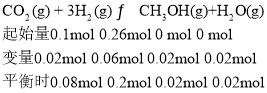
② | 200 | 0.10 | 0.26 | 0.02 |
③ | 200 | 0.17 | a | 0.01 |
实验①平衡常数K=______,若在该温度下起始时加入二氧化碳、氢气、甲醇气体和水蒸气各0.10 mol,这时反应向________移动(填“正反应方向”、“逆反应方向”或“不”),判断理由是______。
实验②达到平衡时H2转化率为____。
实验③a=_________。
(3)甲醇、空气和稀硫酸可以形成燃料电池,其正极电极反应式为________。
【答案】弱 259 4.5 逆反应方向 Q=![]() 23.08% 0.13
23.08% 0.13 ![]()
【解析】
(1)根据△H=反应的总键能-生成物的总键能,有△H=(2×750+3EH-H)kJ·mol-1-(3EC-H×2+465×3)kJ·mol-1=-49kJ·mol-1,则EH-H-EC-H=63kJ·mol-1>0,因此甲醇中C-H键比氢气中H-H键弱;
根据△H=正反应活化能-逆反应的活化能=Ea(正)-Ea(逆)=-49kJ·mol-1,解得Ea(逆)=259KJ/mol;
(2)利用三等式求平衡常数,有
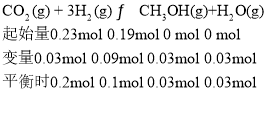
则实验①的平衡常数![]() ;
;
若在该温度下起始时加入二氧化碳、氢气、甲醇气体和水蒸气各0.10mol,此时的浓度商![]() ,则此时反应向逆反应方向移动;
,则此时反应向逆反应方向移动;
实验②,开始投入H2的物质的量为0.26mol,达到平衡时得到0.02molCH3OH,根据化学方程式,需要消耗0.06molH2,则氢气的转化率达到平衡时H2的转化率,有![]() ;
;
实验③和实验②所处温度相同,平衡常数相同,利用平衡常数相同,求a的值,利用三等式和实验②,求出该温度下的平衡常数,有
则实验③的三等式,有
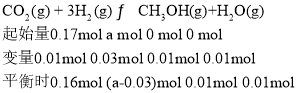 ;
;
因温度相同,则平衡常数相等![]()
解得a=0.13;
(3)甲醇、空气和稀硫酸可以形成燃料电池,正极得电子,发生还原反应,则正极反应式为O2+4e-+4H+=2H2O。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:

| 苯 | 溴 | 溴苯 |
密度 | | | |
沸点 | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入![]() 液态溴。向a中滴入几滴溴,有白雾产生,是因为生成了________气体。继续滴加至液溴滴完。装置d的作用是________________________;
液态溴。向a中滴入几滴溴,有白雾产生,是因为生成了________气体。继续滴加至液溴滴完。装置d的作用是________________________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、![]() 的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是_____;
的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是_____;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是______;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必需的是___![]() 填入正确选项前的字母
填入正确选项前的字母![]() ;
;
a.重结晶 b.过滤 c.蒸馏 d.萃取
(4)在该实验中,a的容积最适合的是________。
a.25 mL ![]()
![]()
![]()