题目内容
某二元酸H2A在水溶液中发生电离:H2A?H++HA-,HA-?H++A2-.下列叙述不正确的是( )A.在NaHA溶液中一定是:c(Na+)>c(HA-)>c(OH-)>c(H+)
B.在Na2A溶液中一定是:c(Na+)>c(A2-)>c(OH-)>c(H+)
C.在NaHA溶液中一定是:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-)
D.在H2A溶液中一定是:c(H+)=c(HA-)+2c(A2-)+c(OH-)
【答案】分析:A、依据电离过程可知二元酸是弱酸,HA-离子水解显碱性,电离显酸性;
B、依据电离过程可知二元酸是弱酸,A2-水解显碱性;
C、依据溶液中电荷守恒计算分析;
D、溶液中存在电荷守恒;
解答:解:A、二元酸H2A在水溶液中发生电离:H2A?H++HA-,HA-?H++A2-.说明是二元弱酸,HA-离子存在两种趋势,电离和水解,电离大于水解溶液显酸性,水解大于电离溶液显碱性,故A错误;
B、在Na2A溶液中A2-离子水解溶液显碱性,溶液中离子浓度一定是:c(Na+)>c(A2-)>c(OH-)>c(H+),故B正确;
C、在NaHA溶液中存在阳离子是Na+、H+,阴离子HA-、A2-、OH-,溶液中电荷守恒一定是:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),故C正确;
D、在H2A溶液中阳离子H+,阴离子HA-、A2-、OH-,溶液中存在电荷守恒一定是:c(H+)=c(HA-)+2c(A2-)+c(OH-),故正确;
故选A.
点评:本题考查了盐类水解的应用,离子浓度大小的比较,溶液中的电荷守恒应用,关键是酸式盐存在的电离和水解程度大小的确定.
B、依据电离过程可知二元酸是弱酸,A2-水解显碱性;
C、依据溶液中电荷守恒计算分析;
D、溶液中存在电荷守恒;
解答:解:A、二元酸H2A在水溶液中发生电离:H2A?H++HA-,HA-?H++A2-.说明是二元弱酸,HA-离子存在两种趋势,电离和水解,电离大于水解溶液显酸性,水解大于电离溶液显碱性,故A错误;
B、在Na2A溶液中A2-离子水解溶液显碱性,溶液中离子浓度一定是:c(Na+)>c(A2-)>c(OH-)>c(H+),故B正确;
C、在NaHA溶液中存在阳离子是Na+、H+,阴离子HA-、A2-、OH-,溶液中电荷守恒一定是:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),故C正确;
D、在H2A溶液中阳离子H+,阴离子HA-、A2-、OH-,溶液中存在电荷守恒一定是:c(H+)=c(HA-)+2c(A2-)+c(OH-),故正确;
故选A.
点评:本题考查了盐类水解的应用,离子浓度大小的比较,溶液中的电荷守恒应用,关键是酸式盐存在的电离和水解程度大小的确定.

练习册系列答案
相关题目
(14分)已知二元酸H2A在水中存在以下电离:H2A===H++HA-, HA- H++A2-,试回答下列问题:
H++A2-,试回答下列问题:
(1)NaHA溶液呈________性,理由是 .
(2)某温度下,向10 mL、0.1 mol/L NaHA溶液中加入0.1 m ol/L KOH溶液V mL至中性,此时溶液中以下关系一定正确的是________(填写字母).
ol/L KOH溶液V mL至中性,此时溶液中以下关系一定正确的是________(填写字母).
| A.溶液pH=7 | B.水的离子积KW=c2(OH-) | C.V=10 | D.c(K+)<c( Na+) Na+) |
 Ca2++A2-;ΔH>0,一定温度下CaA饱和溶液中c(Ca2+)·c(A2-)为常数,记作Ksp=c(Ca2+)·c(A2-),Ksp只与温度有关.
Ca2++A2-;ΔH>0,一定温度下CaA饱和溶液中c(Ca2+)·c(A2-)为常数,记作Ksp=c(Ca2+)·c(A2-),Ksp只与温度有关.①温度升高时,Ksp________(填“增大”、“减小”或“不变”,下同).
②向浊液中通入HCl气体,c(Ca2+)________,原因是 .
(4)测得25℃时,CaA的Ksp为2.0×10-11,常温下将10 g CaA固体投入100 mL CaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1 mol/L,则溶液中c(A2+)= ____________mol/L
(16分)已知二元酸H2A在水中存在以下电离:H2A===H++HA-, HA-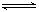 H++A2-,试回答下列问题:
H++A2-,试回答下列问题:
(1)NaHA溶液呈________性,理由是 。
(2)某温度下,向10 mL 0.1 mol/L NaHA溶液中加入0.1 mol/L KOH溶液V mL至中性,此时溶液中以下关系一定正确的是________(填写字母)。
| A.c(Na+)+c(K+)=c(HA-)+c(A2-) | B.水的离子积KW=c 2(OH-) 2(OH-) |
| C.V=10 | D.c(K+)<c(Na+) |
 已知难溶物CaA在水中存在溶解平衡;CaA(s)
已知难溶物CaA在水中存在溶解平衡;CaA(s) 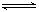 Ca2++A2-;ΔH>0。
Ca2++A2-;ΔH>0。①温度升高时,Ksp________(填“增大”、“减小”或“不变”,下同)。
②向浊液中通入HCl气体,c(Ca2+)________,原因是 。
(4)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3。甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为_______,通过计算确定上述方案______(填“可行”或“不可行”)。
 H++A2-,试回答下列问题:
H++A2-,试回答下列问题: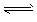 H++A2-,试回答下列问题:
H++A2-,试回答下列问题: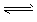 Ca2++A2-;ΔH>0。
Ca2++A2-;ΔH>0。