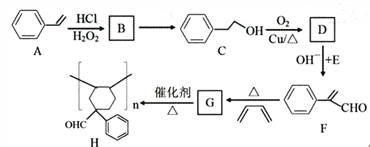
题目内容
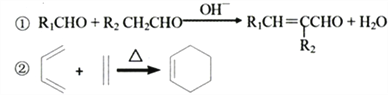
【题目】Ⅰ钠是一种活泼金属,能与很多物质反应,
(1)写出金属钠与水反应的化学方程式,并用双线桥标出电子转移的方向和数目__________________________________
(2)该反应的还原剂是_______,(填化学式,下同)
(3)该反应中被还原的元素是___________. (填元素符号),氧化产物是__________.
(4)若反应转移了0.4 mol电子,则产生的气体在标准状况下体积为____________L.
Ⅱ某研究小组同学为了探究硝酸的性质,进行了如下操作:
(1)从试剂柜里取一瓶浓硝酸,发现其保存在________色的试剂瓶里,原因是(用化学方程式表示)_________________________。打开瓶盖,小心地扇闻浓硝酸的气味。
(2)该研究小组欲用该浓硝酸(15 mol/L)来配制480mL 3 mol/L的稀硝酸,则需要量取的浓硝酸的体积是_________mL。
【答案】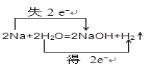 NaHNaOH 4.48 L棕色4HNO3
NaHNaOH 4.48 L棕色4HNO3 ![]() 4NO2↑+ O2↑+ 2H2O100 mL
4NO2↑+ O2↑+ 2H2O100 mL
【解析】
Ⅰ(1)钠和水反应生成氢氧化钠和氢气,反应方程式为:2Na+2H2O=H2↑+2NaOH,转移电子数为2,用双线桥标出电子转移的方向和数目如下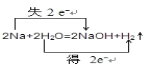 ;(2)反应中钠元素化合价由0价变为+1价,还原剂是Na;(3)反应中氢元素由+1价变为0价,被还原的元素是H,钠被氧化生成NaOH,氧化产物是NaOH;(4)根据反应2Na+2H2O=H2↑+2NaOH,若反应转移了0.4 mol电子,则产生的气体在标准状况下体积为0.4 mol
;(2)反应中钠元素化合价由0价变为+1价,还原剂是Na;(3)反应中氢元素由+1价变为0价,被还原的元素是H,钠被氧化生成NaOH,氧化产物是NaOH;(4)根据反应2Na+2H2O=H2↑+2NaOH,若反应转移了0.4 mol电子,则产生的气体在标准状况下体积为0.4 mol ![]() 4.48L;
4.48L;
Ⅱ(1)浓硝酸见光易分解,方程式为:4HNO3 ![]() 4NO2↑+ O2↑+ 2H2O;应保存在棕色的试剂瓶里;(2)实验室没有480mL规格的容量瓶,必须配制500mL 3 mol/L的稀硝酸溶液,根据稀释定律c1V1=c2V2计算;设所需浓硝酸的体积为x,15 mol/Lx=500 mL×3 mol/L,解得x=100mL。
4NO2↑+ O2↑+ 2H2O;应保存在棕色的试剂瓶里;(2)实验室没有480mL规格的容量瓶,必须配制500mL 3 mol/L的稀硝酸溶液,根据稀释定律c1V1=c2V2计算;设所需浓硝酸的体积为x,15 mol/Lx=500 mL×3 mol/L,解得x=100mL。

【题目】T1 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1),下列说法错误的是( )
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1),下列说法错误的是( )
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 2.00 | 3.00 |
t1 | 0.80 | |
t2 | 1.80 |
A. 用H2表示反应在t1 min内的平均速率为v(H2)=0.60/t1mol·L-1·min-1
B. 保持其他条件不变,若起始时向容器中充入3.00 mol CO和2.00 mol H2O(g),达到平衡时,n(CO2)=1.20 mol
C. 保持其他条件不变,在t2 min时向容器中再通入1.00 mol CO,与原平衡相比,达到新平衡时CO转化率将增大
D. 温度升至T2 ℃,上述反应的平衡常数为0.70,则正反应的ΔH<0
【题目】为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂和分离方法都正确的是( )
选项 | A | B | C | D |
被提纯的物质 | 水(煤油) | 氯乙烷(水) | 甲苯(水) | 乙醇(乙酸) |
除杂试剂 | — | NaOH溶液 | — | NaOH溶液 |
分离方法 | 分液 | 蒸馏 | 过滤 | 分液 |
A.AB.BC.CD.D