题目内容
浓硫酸和铜在加热时反应,生成二氧化硫气体的体积为3.36L(标准状况下).Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O.试计算:
CuSO4+SO2↑+2H2O.试计算:(1)反应生成硫酸铜的物质的量;
(2)被还原的H2SO4的质量是多少?
【答案】分析:(1)由Cu+2H2SO4(浓)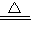 CuSO4+SO2↑+2H2O可知,n(SO2)=n(CuSO4);
CuSO4+SO2↑+2H2O可知,n(SO2)=n(CuSO4);
(2)由Cu+2H2SO4(浓)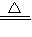 CuSO4+SO2↑+2H2O可知,被还原的硫酸的物质的量等于二氧化硫的物质的量,再利用m=nM来计算质量.
CuSO4+SO2↑+2H2O可知,被还原的硫酸的物质的量等于二氧化硫的物质的量,再利用m=nM来计算质量.
解答:解:(1)标准状况下Vm=22.4L/mol,
二氧化硫的物质的量为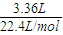 =0.15mol,
=0.15mol,
由Cu+2H2SO4(浓)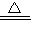 CuSO4+SO2↑+2H2O可知,
CuSO4+SO2↑+2H2O可知,
n(SO2)=n(CuSO4)=0.15mol,
答:反应生成硫酸铜的物质的量为0.15mol;
(2)由Cu+2H2SO4(浓)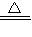 CuSO4+SO2↑+2H2O可知,
CuSO4+SO2↑+2H2O可知,
被还原的硫酸的物质的量等于二氧化硫的物质的量,
则被还原的硫酸的质量为0.15mol×98g/mol=14.7g,
答:被还原的H2SO4的质量是14.7g.
点评:本题较简单,考查学生利用已知的氧化还原反应来计算氧化产物及作氧化剂的硫酸物质的量,能根据反应确定物质的物质的量是解答的关键,难度不大.
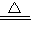 CuSO4+SO2↑+2H2O可知,n(SO2)=n(CuSO4);
CuSO4+SO2↑+2H2O可知,n(SO2)=n(CuSO4);(2)由Cu+2H2SO4(浓)
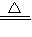 CuSO4+SO2↑+2H2O可知,被还原的硫酸的物质的量等于二氧化硫的物质的量,再利用m=nM来计算质量.
CuSO4+SO2↑+2H2O可知,被还原的硫酸的物质的量等于二氧化硫的物质的量,再利用m=nM来计算质量.解答:解:(1)标准状况下Vm=22.4L/mol,
二氧化硫的物质的量为
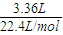 =0.15mol,
=0.15mol,由Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O可知,
CuSO4+SO2↑+2H2O可知,n(SO2)=n(CuSO4)=0.15mol,
答:反应生成硫酸铜的物质的量为0.15mol;
(2)由Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O可知,
CuSO4+SO2↑+2H2O可知,被还原的硫酸的物质的量等于二氧化硫的物质的量,
则被还原的硫酸的质量为0.15mol×98g/mol=14.7g,
答:被还原的H2SO4的质量是14.7g.
点评:本题较简单,考查学生利用已知的氧化还原反应来计算氧化产物及作氧化剂的硫酸物质的量,能根据反应确定物质的物质的量是解答的关键,难度不大.

练习册系列答案
相关题目
乙醇分子中各化学键如下图所示,乙醇在以下各种反应中对应断键说明不正确的是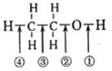
| A.和金属钠作用时,键①断裂 |
| B.和乙酸、浓硫酸共热时,键①断裂 |
| C.和浓硫酸共热至170℃时,键②和④断裂 |
| D.在铜催化下和氧气加热反应时,键①和③断裂 |
 填空题
填空题
