题目内容
【题目】将一定质量的镁铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液的体积的关系如图所示. 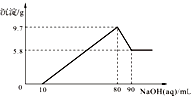
(1)当沉淀达到最大值时,Al(OH)3的质量;
(2)原合金中Mg的质量;
(3)盐酸的物质的量浓度.
【答案】
(1)解:氢氧化镁沉淀的质量为5.8g,氢氧化铝沉淀的质量为:(9.7﹣5.8)g=3.9g,
答:当沉淀达到最大值时,Al(OH)3的质量为3.9g
(2)解:根据守恒法可知,n(Mg)=n(Mg(OH)2)= ![]() =0.1mol,故镁的质量为:0.1mol×24g/mol=2.4g,
=0.1mol,故镁的质量为:0.1mol×24g/mol=2.4g,
答:原合金中Mg的质量为2.4g
(3)解:当氢氧化钠加入量为80mL时,溶质均为NaCl,根据守恒法可知,n(HCl)=n(Cl﹣)=n(NaOH)=0.08L×5mol/L=0.4mol,
则该盐酸的物质的量浓度为:c(HCl)= ![]() =4mol/L,
=4mol/L,
答:盐酸的物质的量浓度为4mol/L
【解析】解:从图中横坐标可以看出,加入10mL的氢氧化钠溶液时,没有产生沉淀,此段是盐酸与氢氧化钠发生中和反应; 当氢氧化钠继续加入时,沉淀不断增加,沉淀为氢氧化镁和氢氧化铝,直到沉淀最大值;
加入10mL氢氧化钠溶液后继续滴加氢氧化钠溶液,则氢氧化铝参与反应,生成偏铝酸钠,故5.8g沉淀是氢氧化镁,(9.7﹣5.8)g=3.9g为氢氧化铝的质量;

练习册系列答案
相关题目