题目内容
【题目】明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:
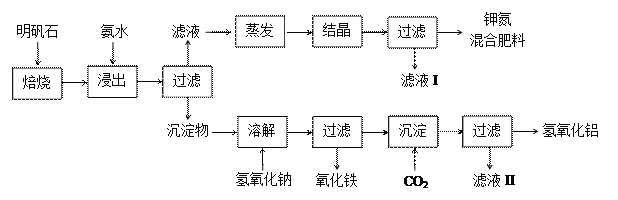
根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出。需用到480mL稀氨水(每升含有39g氨),需要取浓氨水(每升含有210g氨)_________mL来配制(数值取整数),用规格为_________mL量筒量取。氨水浸出后过滤所用到的玻璃仪器的名称是______________________________。
(2)氨水浸出后得固体混合体系,过滤,滤液中除含K+、SO42-外,还含有大量的NH4+。检验NH4+的方法是____________________________________________。
(3)沉淀物中所有物质的化学式_______________________。
(4)写出通入过量CO2生成氢氧化铝的离子方程式________________________________________。
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,请完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量__________溶液,产生白色沉淀。
②________、洗涤、_________。其中洗涤沉淀的方法为_______________。
③冷却、称重。
(6)若试样为m g,沉淀的物质的量为n mol,则试样中K2SO4的物质的量为:____________mol(用含有m、n的代数式表示)。
【答案】 93 100 漏斗、玻璃棒、烧杯 取滤液少许,加入NaOH溶液,加热,生成的气体能使润湿的红色石蕊试纸变蓝 Al(OH)3、Al2O3和Fe2O3 AlO2- +CO2 +2 H2O === Al(OH)3↓+HCO3- BaCl2[或Ba(OH)2] 过滤 干燥 沿玻璃棒向漏斗中加入蒸馏水至恰好浸没沉淀,待水自然滤出后,重复操作2~3次 ![]()
【解析】试题分析:由题中信息可知:明矾石的主要成分是十二水合硫酸铝钾,明矾石经焙烧后用氨水浸出,铝离子与氨水反应可以转化为氢氧化铝,过滤后,将滤液蒸发、结晶、过滤,可得到钾氮混合肥料。浸出过滤后的沉淀物中主要含Al(OH)3、Al2O3和Fe2O3,经氢氧化钠溶液溶解后,Al(OH)3和Al2O3转化为偏铝酸钠,过滤除去不溶物氧化铁后得到含偏铝酸钠的滤液,向滤液中通入足量的二氧化碳后生成氢氧化铝沉淀,再过滤,得到氢氧化铝。
(1)需要480mL稀氨水(每升含有39g氨),应该用500mL的容量配制500mL该氨水,配制好之后量取480mL即可。500mL该稀氨水中含有0.5L![]() g/L=19.5g氨,需要量取浓氨水(每升含有210g氨)的体积是
g/L=19.5g氨,需要量取浓氨水(每升含有210g氨)的体积是![]() 93mL,故选用规格为100 mL量筒量取浓氨水。过滤所用到的玻璃仪器有:漏斗、玻璃棒、烧杯。
93mL,故选用规格为100 mL量筒量取浓氨水。过滤所用到的玻璃仪器有:漏斗、玻璃棒、烧杯。
(2)检验NH4+的方法是:取滤液少许,加入NaOH溶液,加热,生成的气体能使润湿的红色石蕊试纸变蓝,则滤液中有NH4+。
(3)沉淀物中所含的物质主要是Al(OH)3、Al2O3和Fe2O3等。
(4)通入过量CO2生成氢氧化铝,该反应的离子方程式为AlO2- +CO2 +2 H2O === Al(OH)3↓+HCO3-。
(5)由题意可知,测定混合肥料K2SO4、(NH4)2SO4中钾的含量的原理是,取一定质量的样品溶于水,然后加入钡试剂将硫酸根离子完全沉淀,根据样品的质量和硫酸钡的质量就可以求出样品中硫酸钾的质量,进一步可以求出钾的含量。实验步骤是:①称取钾氮肥试样并溶于水,加入足量BaCl2[或Ba(OH)2]溶液,产生白色沉淀。②过滤、洗涤、干燥。其中洗涤沉淀的方法为:沿玻璃棒向漏斗中加入蒸馏水至恰好浸没沉淀,待水自然滤出后,重复操作2~3次。③冷却、称重。
(6)由试样中K2SO4、(NH4)2SO4的总质量为m g,可得174g/mol![]() n(K2SO4)+132g/mol
n(K2SO4)+132g/mol![]() n[(NH4)2SO4];硫酸钡沉淀的物质的量为n mol,由硫酸根离子守恒可得n(K2SO4)+ n[(NH4)2SO4]= n mol,则试样中K2SO4的物质的量为
n[(NH4)2SO4];硫酸钡沉淀的物质的量为n mol,由硫酸根离子守恒可得n(K2SO4)+ n[(NH4)2SO4]= n mol,则试样中K2SO4的物质的量为![]() mol。
mol。

 阅读快车系列答案
阅读快车系列答案